
 如图是一种锂钒氧化物热电池装置,电池总反应为xLi+LiV3O8=Li1+xV3O8.工作时,需先引发铁和氯酸钾反应使共晶盐融化.已知:Li熔点181℃,LiCl-KCl共晶盐熔点352℃.下列说法正确的是( )
如图是一种锂钒氧化物热电池装置,电池总反应为xLi+LiV3O8=Li1+xV3O8.工作时,需先引发铁和氯酸钾反应使共晶盐融化.已知:Li熔点181℃,LiCl-KCl共晶盐熔点352℃.下列说法正确的是( )| A. | 整个过程的能量转化只涉及化学能转化为电能 | |
| B. | 放电时正极反应为:Li1+xV3O8-xe?═LiV3O8+xLi+ | |
| C. | 放电时Cl?移向LiV3O8电极 | |
| D. | Li-Si合金熔点高于352℃ |
分析 放电时,电池反应式为xLi+LiV3O8=Li1+xV3O8,负极反应式为xLi-xe-═xLi+,正极反应式为xLi++LiV3O8+xe-═Li1+xV3O8,充电时,阳极、阴极电极反应式与正极、负极电极反应式正好相反,据此分析解答.
解答 解:A、整个过程的能量转化涉及化学能转化为电能以及化学能和热能之间的转化,故A错误;
B、放电时正极发生得电子的还原反应,即反应为:正极反应式为xLi++LiV3O8+xe-═Li1+xV3O8,故B错误;
C、放电时Cl?移向负极,移向锂电极,故C错误;
D、根据工作时,需先引发铁和氯酸钾反应使共晶盐融化,得到:Li-Si合金熔点高于352℃,故D正确.
故选D.
点评 本题考查化学电源新型电池,明确各个电极上发生的反应是解本题关键,知道正负极与阴阳极电极反应式之间的关系,难点是电极反应式的书写.


科目:高中化学 来源: 题型:选择题
| A. | 在偏铝酸钠溶液中滴入少量的碳酸氢钠溶液HCO3-+AlO2-+H2O=Al(OH)3↓+CO2↑ | |
| B. | 向明矾溶液中逐滴加入Ba(OH)2溶液至Al3+离子刚好完全沉淀2Al3++6OH-+3Ba2++3SO42-=2Al(OH)3↓+3BaSO4↓ | |
| C. | 在碳酸氢镁溶液中逐滴加入澄清石灰水至过量Ca2++Mg2++2HCO3-+2OH-=CaCO3↓+2H2O+MgCO3↓ | |
| D. | 氢氧化铁固体溶于氢碘酸 Fe(OH)3+3H+=Fe3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠溶液呈碱性:NaHCO3═Na++HCO3- | |
| B. | 试管上的银镜用稀硝酸洗涤:Ag+2H+═2 Ag++H2↑ | |
| C. | 澄清苯酚钠溶液中通入二氧化碳气体,出现浑浊: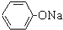 +H2O+CO2→ +H2O+CO2→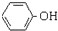 +NaHCO3 +NaHCO3 | |
| D. | 氨水与少量SO2反应:NH3?H2O+SO2═NH4++HSO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaO | B. | NaHCO3 | C. | SiO2 | D. | CaCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
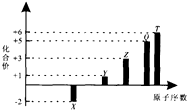
| A. | 1 mol TX2与足量X2反应生成TX3的分子数目为NA | |
| B. | Z元素形成的可溶性盐溶液可能显碱性 | |
| C. | 1 mol Y2X2与足量H2O反应转移的电子数目为2NA | |
| D. | 0.1 molQ元素的含氧酸在水中电离出的H十数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
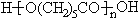 }及阻燃剂四溴双酚A.合成线路如下:
}及阻燃剂四溴双酚A.合成线路如下: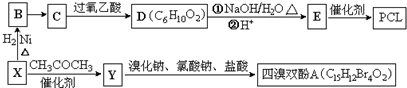
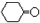
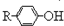 $\stackrel{溴化钠、氯酸钠、盐酸}{→}$
$\stackrel{溴化钠、氯酸钠、盐酸}{→}$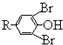
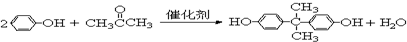 .
.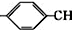 =CH2+2ROH+2CO+O2$\stackrel{一定条件}{→}$2CH3
=CH2+2ROH+2CO+O2$\stackrel{一定条件}{→}$2CH3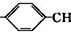 =CHCOOR+2H2O
=CHCOOR+2H2O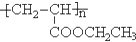 ,写出合成该涂料的反应流程图:
,写出合成该涂料的反应流程图: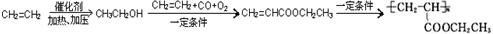 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
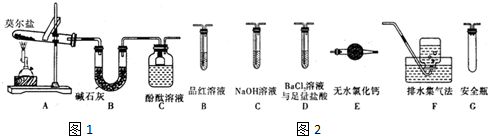
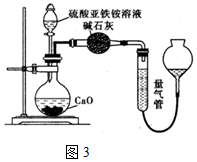
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
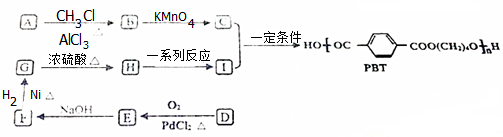
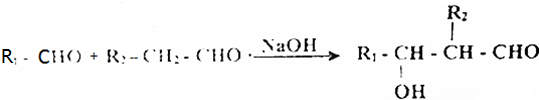
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com