
【题目】在一密闭的2L的容器里装有4mol SO2和2mol O2,在一定条件下开始反应。2min末测得容器中共有5.2mol 气体,试计算:
(1)2min末SO3气体的物质的量浓度;
(2)2min内O2的平均反应速率v(O2);
(3)2min末SO2的转化率.
【答案】(1)2min末SO3气体的物质的量浓度为0.8mol/L,
(2)2min内O2的平均反应速率v(O2)为0.2mol/(L.min),
(3)2min末SO2的转化率为40%.
【解析】在一密闭的2L的容器里装有4mol SO2和2mol O2,根据c=![]() 可知SO2和O2开始时的浓度分别为2mol/L、1mol/L,设2min末SO2改变的浓度为xmol/L,则
可知SO2和O2开始时的浓度分别为2mol/L、1mol/L,设2min末SO2改变的浓度为xmol/L,则
2SO2 + O2 ![]() SO3
SO3
起始浓度(mol/L) 2 1 0
转化浓度(mol/L) x ![]() x
x
2min后浓度(mol/L) 2-x 1- ![]() x
x
则:(2-x+1-![]() +x)mol/L×2L=5.2mol ,解得:x=0.8mol/L
+x)mol/L×2L=5.2mol ,解得:x=0.8mol/L
(1)2min末SO3气体的物质的量浓度为:x=0.8mol/L;
(2)2min内O2的平均反应速率v(O2)=![]() =
=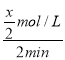 =
=![]() =0.2mol/(Lmin);
=0.2mol/(Lmin);
(3)2min末SO2的转化率=![]() ×100%=40%。
×100%=40%。


科目:高中化学 来源: 题型:
【题目】下图是某化学研究性学习小组设计的铜与稀硝酸反应的两个实验装置图。其中装置I为甲同学设计。

请回答下列问题:
(1)铜与稀硝酸反应的离子方程式为:__________________。
(2)装置I的试管中收集到NO,乙同学认为这也不能确定铜与稀硝酸反应生成的气体是NO,理由是______________________。于是他设计装置II,其中装铜片的是气球。
(3)研究性小组的同学共同对上述实验进行了研究,认为装置II虽然作了改进,但如果按装置II进行实验,还存在问题,需要作相应改进。
①问题一:反应速度较慢。
措施:___________或_________________。
②问题二:试管中的气体是淡棕红色,而不是无色。
措施:现将少量的固体________倒入试管,然后迅速系上装有铜的小气球。
A.Na2SO4 B. CH3COONa C. NaHCO3
③问题三:____________________。
措施:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】谢弗勒尔盐(Cu2SO3·CuSO3·2H2O)是一种深红色固体,不溶于水和乙醇,100℃时发生分解。可由CuSO4·5H2O和SO2等为原料制备,实验装置如下图所示:

(1)装置A在常温下制取SO2时,用较浓的硫酸而不用稀硫酸,其原因是_______________。
(2)装置B中发生反应的离子方程式为_______________。
(3)装置C的作用是____________________。
(4)从B中获得的固体需先用蒸馏水充分洗涤,再真空干燥。
①检验洗涤已完全的方法是__________________。
②不用烘干的方式得到产品,其原因是________________。
(5)请补充完整由工业级氧化铜(含少量FeO)制备实验原料(纯净CuSO4·5H2O)的实验方案:向工业级氧化铜中边搅拌边加入稍过量的硫酸溶液,微热使其完全溶解,_______________,过滤,用95%酒精洗涤晶体2~3次,晾干,得到CuSO4·5H2O。
[已知:①该溶液中氢氧化物开始沉淀与沉淀完全时的pH范围分别为:Fe(OH)2(5.8,8.8);Cu(OH)2(4.2,6.7);Fe(OH)3(1.1,3.2)。②在水溶液中超过100℃,硫酸铜晶体易失去结晶水。③硫酸铜晶体溶解度曲线如右图所示]

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机高分子材料M其结构简式为![]() ,下图是由有机物A(分子式为C5H8O)和苯甲醛为原料生产该有机物的合成路线。
,下图是由有机物A(分子式为C5H8O)和苯甲醛为原料生产该有机物的合成路线。

已知:① A分子中有两种不同环境的氢原子
② CH3CH2CH=CH2 ![]() CH3CHBrCH=CH2
CH3CHBrCH=CH2
CH3CHO+ CH3CHO ![]()
![]()
请回答以下问题:
(1)A的结构简式为_____,B 的名称为_____,F中所含官能团的名称是______。
(2)①和③的反应类型分别是_______、______;反应② 的反应条件为_______。
(3)反应④的化学方程式为______________。
(4)有机物E有多种同分异构体,其中同时符合下列条件的同分异构体有_____________种。
① 属于芳香酯类 ② 其酸性水解产物遇FeC13 显紫色
(5)以l-丙醇和NBS为原料可以制备聚丙烯醇(![]() )。请设计合成路线(其他无机原料任选)并用如下方式表示:__________________
)。请设计合成路线(其他无机原料任选)并用如下方式表示:__________________
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤化工中常需研究不同温度下平衡常数、投料比及产率等问题。
已知:CO(g)+H2O(g)![]() H2(g)+CO2(g)的平衡常数随温度的变化如下表:
H2(g)+CO2(g)的平衡常数随温度的变化如下表:
温度/℃ | 400 | 500 | 830 | 1 000 |
平衡常数K | 10 | 9 | 1 | 0.6 |
试回答下列问题:
(1)上述反应平衡常数的表达式为 _____________,正反应是___________反应(填“放热”或“吸热”)。
(2)某温度下,上述反应达到平衡后,保持容器体积不变升高温度,正反应速率___________(填“增大”“减小”或“不变”),容器内混合气体的压强______________(填“增大”“减小”或“不变”)。
(3)830 ℃时,在恒容反应器中发生上述反应,按下表中的物质的量投入反应混合物,其中向正反应方向进行的有 ____________ (选填字母)。
A | B | C | D | |
n(CO2)/mol | 3[ | 1 | 0 | 1 |
n(H2)/mol | 2 | 1 | 0 | 1 |
n(CO)/mol | 1 | 2 | 3 | 0.5 |
n(H2O)/mol | 5[ | 2 | 3 | 2 |
(4)830 ℃时,在2 L的密闭容器中加入4 mol CO(g)和6 mol H2O(g)达到平衡时,CO的转化率是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)完全燃烧0.1 mol某烃,燃烧产物依次通过浓硫酸、浓碱液,实验结束后,称得浓硫酸增重9 g,浓碱液增重17.6 g。该烃的化学式________,并写出其所有可能的结构简式:___________________。
(2)两种气态烃以任意比例混合,在120℃时1L该混合烃与9L氧气混合,充分燃烧后恢复到原状态,所得气体仍为10L。则两气态烃的分子的组成要符合的条件是_________________。
(3)如图所示,将浸透了石蜡油(分子中含有17个碳原子以上的液态烷烃混合物)的矿渣棉放置在硬质试管的底部,试管中加入碎瓷片,给碎瓷片加强热,石蜡油蒸气通过碎瓷片表面,发生反应,可得到一定量的气体生成物,用该生成物进行如下实验:
①生成的气体通入酸性KMnO4溶液中,溶液褪色。
②生成的气体通入Br2的CCl4溶液中,溶液褪色。
③用排水法收集一试管气体,点燃,燃烧时火焰明亮,有黑烟产生(甲烷燃烧时火焰为淡蓝色,无烟)。
根据以上现象思考:
A.用其最简单的同系物为例,写出②的反应方程式:___________。
B.碎瓷片的作用是_________________________。
C.产生黑烟的原因是_______________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《梦溪笔谈》中记载有:“信州铅山县有苦泉,流以为涧。挹其水熬之,则成胆矾。烹胆矾则成铜;熬胆矾铁釜,久之亦化为铜。”下列对文中内容的解释正确的是( )
A. “苦泉”可使蛋白质变性 B. 胆矾的化学式为CuSO4
C. 胆矾受热不能分解 D. 胆矾与铁通过复分解反应可炼铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是

A. 图甲表示向CH3COOH溶液中逐步加入CH3COONa固体后,溶液pH的变化
B. 图乙表示0.1LpH=2的HC1溶液加水稀释至VL, pH随lgV的变化
C. 图丙表示不同温度下水溶液中H+和OH-浓度变化的曲线,图中温度T2>T1
D. 图丁表示同一温度下,再不同容积的容器中进行反应2BaO2(s)![]() 2BaO(S)+O2(g),O2的平衡浓度与容器容积的关系
2BaO(S)+O2(g),O2的平衡浓度与容器容积的关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是一种重要的元素,其对应化合物在生产生活中有重要的应用。
(1)氮化铝(AlN)可用于制备耐高温的结构陶瓷,遇强碱会腐蚀,写出AlN与氢氧化钠溶液反应的离子方程式_______________。
(2)氨是制备氮肥、硝酸等的重要原料②③
①己知:N2(g)+3H2(g) ![]() 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
N2(g)+O2(g) ![]() 2NO(g) △H=+180 kJ/mol
2NO(g) △H=+180 kJ/mol
2H2(g)+O2(g) ![]() 2H2O(1) △H= -571.6 kJ/mol
2H2O(1) △H= -571.6 kJ/mol
试写出表示氨的标准燃烧热的热化学方程式________________。
②某电解法制氨的装置如右图所示,电解质只允许质子通过,试写出阴极的电极反应式__________。

(3)反应:2NO(g)+O2(g)![]() 2NO2(g)△H<0是制备硝酸过程中的一个反应。
2NO2(g)△H<0是制备硝酸过程中的一个反应。
①将NO和O2按物质的量之比为2:1置于恒温恒容密闭容器中进行上述反应,得到NO2体积分数与时间的关系如下图所示。保持其它条件不变,t1时再向容器中充入适量物质的量之比为2:1的NO和O2的混合气体,t2时再次达到平衡,请画出tl-t3时间范围内NO2体积分数随时间的变化曲线:____________。

②在研究此反应速率与温度的关系时发现,NO转化成NO2的速率随温度升高反而减慢。进一步研究发现,上述反应实际是分两步进行的:
I 2NO(g) ![]() N2O2(g) △H<0
N2O2(g) △H<0
II N2O2(g)+O2(g) ![]() 2NO2(g) △H<0
2NO2(g) △H<0
已知反应I能快速进行,试结合影响化学反应速率的因素和平衡移动理论分析,随温度升高,NO转化成NO2的速率减慢的可能原因________。
(4)已知常温下,Ka(CH3COOH)=Kb(NH3·H2O)=l.8×l0-5。则常温下0.lmol/L的CH3COONH4溶液中,(CH3COO-):c(NH3·H2O)=________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com