
| A、60% | B、24% |
| C、30% | D、40% |
| 1.2mol |
| 3mol |


科目:高中化学 来源: 题型:
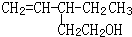 具有一定的光学活性,请你列举两种使该物质失去光学活性的方法
具有一定的光学活性,请你列举两种使该物质失去光学活性的方法查看答案和解析>>
科目:高中化学 来源: 题型:
| A、大于25.3% |
| B、小于25.3% |
| C、等于25.3% |
| D、约等于25.3% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 容器编号 | 起始时各物质物质的量/mol | 达到平衡的时间/min | 达平衡时体系能量的变化/kJ | ||||
| CO | H2O | CO2 | H2 | ||||
| ① | 1 | 4 | 0 | 0 | t1 | 放出热量:32.8 kJ | |
| ② | 2 | 8 | 0 | 0 | t2 | 放出热量:Q | |
| 4 |
| Vt1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
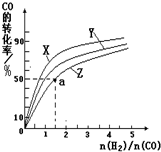 碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是理想,更是一种值得期待的新的生活方式,请运用化学反应原理的相关知识研究碳及其化合物的性质.
碳和碳的化合物在生产、生活中的应用非常广泛,在提倡健康生活已成潮流的今天,“低碳生活”不再只是理想,更是一种值得期待的新的生活方式,请运用化学反应原理的相关知识研究碳及其化合物的性质.| 1 |
| 2 |
| 1 |
| 2 |
| 0min | 5min | 10min | |
| CO | 0.1 | 0.05 | |
| H2 | 0.2 | 0.2 | |
| CH3OH | 0 | 0.04 | 0.05 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| AlT/(mol?L-1) | Ala/% | Alb/% | A1c/% |
| 0.208 | 1.4 | 86.6 | 12.0 |
| 0.489 | 2.3 | 86.2 | 11.5 |
| 0.884 | 2.3 | 88.1 | 9.6 |
| 1.613 | 3.1 | 87.0 | 9.9 |
| 2.520 | 4.5 | 88.2 | 7.3 |
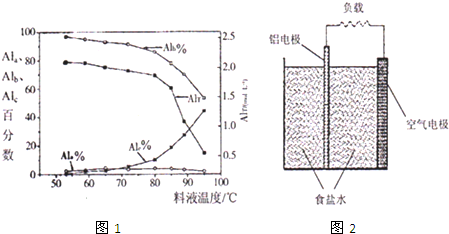
查看答案和解析>>
科目:高中化学 来源: 题型:
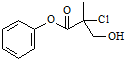
| A、有机物A属于芳香烃 |
| B、有机物A可以和Br2的CCl4溶液发生加成反应 |
| C、有机物A遇FeCl3溶液显紫色 |
| D、1molA和足量的NaOH溶液反应,最多可以消耗3molNaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com