
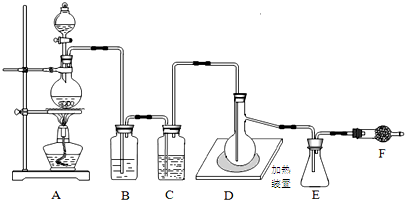
分析 装置A制备氯气,装置B吸收氯气的中HCl,装置C干燥氯气,D装置生成SCl2,E装置收集SCl2,F装置吸收多余的氯气,吸收空气中水蒸气,防止进入E中,
(1)制备气体,装置气密性要好;加热硫粉时,空气中的氧气能与硫粉反应;
(2)用饱和氯化钠溶液吸收HCl;由仪器5的特征,可知为蒸馏烧瓶;增大反应物接触面积;
(3)二氯化硫(SCl2)的沸点低,易挥发,可以用冰水冷却;防止空气中水蒸气进入;
(4)根据方程式判断硫黄、液氯和液体三氧化硫的物质的量之比;
解答 解:装置A制备氯气,装置B吸收氯气的中HCl,装置C干燥氯气,D装置生成SCl2,E装置收集SCl2,F装置吸收多余的氯气,吸收空气中水蒸气,防止进入E中.
(1)仪器组装完成后,首先进行的一步操作是:检查装置气密性;加热硫粉时,空气中的氧气与硫粉反应,应先排尽系统中空气,
故答案为:检查装置气密性;防止加热硫粉时,空气中的氧气与硫粉反应;
(2)B装置吸收氯气中的HCl,用饱和氯化钠溶液反应吸收;由仪器5的特征,可知为蒸馏烧瓶,
故答案为:饱和氯化钠溶液;蒸馏烧瓶;
(3)二氯化硫(SCl2)的沸点低,为防止SCl2中液体挥发,可采取将锥形瓶放入冰水中冷却等措施,装置F(盛放碱石灰)有两个作用:一是吸收多余的氯气,另一个是:防止空气中水蒸气进入,
故答案为:将锥形瓶放入冰水中冷却;防止空气中水蒸气进入;
(4)由S(s)+Cl2(g)$\frac{\underline{\;\;△\;\;}}{\;}$SCl2(l)、SCl2(l)+SO3(l)═SOCl2(l)+SO2(g)可知硫黄、液氯和液体三氧化硫的物质的量之比为1:1:1,
故答案为:1:1:1.
点评 本题考查化学实验制备方案,涉及基本操作、对操作与装置的分析评价、物质检验等,较好的考查学生对知识的迁移运用能力,难度中等.


科目:高中化学 来源: 题型:解答题
 能源问题是当前人类社会面临的一项重大课题,H2、CO、CH3OH都是重要的能源物质,它们的燃烧热依次为285.8kJ/mol、282.5kJ/mol、726.7kJ/mol.请回答:
能源问题是当前人类社会面临的一项重大课题,H2、CO、CH3OH都是重要的能源物质,它们的燃烧热依次为285.8kJ/mol、282.5kJ/mol、726.7kJ/mol.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 某无色稀溶液X中,可能含有下表所列离子中的某几种.
某无色稀溶液X中,可能含有下表所列离子中的某几种.| 阴离子 | CO32-、SiO32-、AlO2-、Cl- |
| 阳离子 | Al3+、Fe3+、Mg2+、NH4+、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑ | B. | H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl | ||
| C. | 2HCl+Zn═ZnCl2+H2↑ | D. | NaCl+AgNO3═AgCl↓+NaNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题



 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  用图所示装置氧化Br- | |
| B. |  用图所示装置萃取Br2 | |
| C. |  用图所示装置分离CCl4和Br2 | |
| D. |  用图所示的装置将含AlCl3的溶液蒸发制取无水AlCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.1 g | B. | 3.6 g | C. | 7.2 g | D. | 无法确定 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com