

·ÖĪö ŅŌĢģĒąŹÆ£ØÖ÷ŅŖ³É·ÖĪŖSrSO4£©ĪŖŌĮĻÖʱøĮłĖ®ĀČ»ÆļČ£ØSrCl2•6H2O£©£¬ÓÉĮ÷³ĢæÉÖŖ£¬ĢģĒąŹÆŗĶĢ¼øō¾ųæÕĘųøßĪĀ±ŗÉÕÉś³ÉCO”¢SrS£¬SrS¼ÓŃĪĖįŗóČÜŅŗÖŠ³żŗ¬ÓŠSr2+ŗĶCl-Ķā£¬»¹ŗ¬ÓŠÉŁĮæBa2+ŌÓÖŹ£¬Č»ŗó¼ÓĮņĖįÉś³ÉĮņĖį±µ³Įµķ£¬ĖłŅŌ¹żĀĖŗóĀĖŌüĪŖĮņĖį±µ£¬ĀĖŅŗÖŠŗ¬SrSO4”¢SrCl2£¬×īŗóÕō·¢”¢ĄäČ“½į¾§µĆµ½SrCl2•6H2O£¬
£Ø1£©ŃŠÄ„·ŪĖéµÄÄæµÄŹĒŌö¼Ó·“Ó¦ĪļµÄ½Ó“„Ć껿£¬Ģįøß·“Ó¦ĖŁĀŹ£¬ĢįøßŌĮĻµÄ×Ŗ»ÆĀŹ£»ÓĆHClČܽāSrSŗóµÄČÜŅŗÖŠŗ¬ÓŠŌÓÖŹ±µĄė×Ó£¬¼ÓČėĮņĖįµÄŗóÉś³ÉĮņĖį±µ³Įµķ“Ó¶ų³żČ„ČÜŅŗÖŠBa2+ŌÓÖŹ£»
£Ø2£©0.5mol SrSO4ÖŠÖ»ÓŠS±»»¹Ō£¬×ŖŅĘĮĖ4molµē×Ó£¬Ōņ1molµÄS×ŖŅĘ8molµÄµē×Ó£¬·“Ó¦ŗóÉś³ÉµÄ-2¼ŪĮņĄė×Ó£¬¾Ż“ĖŠ“³öøĆ·“Ó¦µÄ»Æѧ·½³ĢŹ½£»
£Ø3£©¹żĀĖ1ŗóµÄĀĖŅŗÖŠŗ¬ÓŠĀČ»ÆļČ£¬½«ČÜŅŗÕō·¢ÅØĖõ”¢ĄäČ“½į¾§£¬Č»ŗó“ÓČÜŅŗÖŠ½«¾§Ģå¹żĀĖ³öĄ“£¬Ļ“µÓ³żČ„±ķĆęµÄŌÓÖŹĄė×Ó²¢½ųŠŠøÉŌļ¼“»ńµĆSrCl2•6H2O£»
£Ø4£©øł¾Żn=cV¼ĘĖć³ön£ØNH4SCN£©£¬Ag+ŅŌAgSCN°×É«³ĮµķµÄŠĪŹ½Īö³ö£¬¾Ż“Ė¼ĘĖć³öČÜŅŗÖŠŹ£ÓąµÄAg+µÄĪļÖŹµÄĮæ¼°ÓėCl-·“Ó¦µÄAg+µÄĪļÖŹµÄĮ棬ŌŁøł¾ŻĀČĄė×ÓŹŲŗć¼ĘĖć³ö1.000g²śĘ·ÖŠSrCl2•6H2OµÄĪļÖŹµÄĮæ”¢ÖŹĮ棬×īŗó¼ĘĖć³ö²śĘ·“æ¶Č£®
½ā“š ½ā£ŗ£Ø1£©ĢģĒąŹÆ±ŗÉÕĒ°ĻČŃŠÄ„·ŪĖ飬ĘäÄæµÄŹĒĪŖĮĖŌö¼Ó·“Ó¦ĪļµÄ½Ó“„Ć껿£¬Ģįøß»Æѧ·“Ó¦ĖŁĀŹ£¬“Ó¶ųĢįøßŌĮĻµÄ×Ŗ»ÆĀŹ£¬ŌŚÓĆHClČܽāSrSŗóµÄČÜŅŗÖŠ¼ÓČėĮņĖįµÄÄæµÄŹĒ³żČ„ČÜŅŗÖŠBa2+ŌÓÖŹ£¬
¹Ź“š°øĪŖ£ŗŌö¼Ó·“Ó¦ĪļµÄ½Ó“„Ć껿£¬Ģįøß·“Ó¦ĖŁĀŹ£¬ĢįøßŌĮĻµÄ×Ŗ»ÆĀŹ£»³żČ„ČÜŅŗÖŠBa2+ŌÓÖŹ£»
£Ø2£©ŌŚ±ŗÉյĹż³ĢÖŠČōÖ»ÓŠ0.5 mol SrSO4ÖŠÖ»ÓŠS±»»¹Ō£¬×ŖŅĘĮĖ4 molµē×Ó£¬Ōņ1molµÄS×ŖŅĘ8molµÄµē×Ó£¬ÓÉÓŚŌŚ·“Ó¦Ē°ŌŖĖŲµÄ»ÆŗĻ¼ŪĪŖ+6¼Ū£¬ĖłŅŌ·“Ó¦ŗóŌŖĖŲµÄ»ÆŗĻ¼ŪĪŖ-2¼Ū£¬Ņņ“ĖĢ¼ÓėĢģĒąŹÆŌŚøßĪĀĻĀ·¢Éś·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗSrSO4+4C$\frac{\underline{\;øßĪĀ\;}}{\;}$SrS+4CO”ü£¬
¹Ź“š°øĪŖ£ŗSrSO4+4C$\frac{\underline{\;øßĪĀ\;}}{\;}$SrS+4CO”ü£»
£Ø3£©Č»ŗóĻņµĆµ½µÄŗ¬ÓŠSrS¹ĢĢåÖŠ¼ÓČėHCl·¢Éś·“Ó¦£ŗSrS+2HCl=SrCl2+H2S”ü£¬½«ČÜŅŗÕō·¢ÅØĖõ”¢ĄäČ“½į¾§£¬Č»ŗó“ÓČÜŅŗÖŠ½«¾§Ģå¹żĀĖ³öĄ“£¬Ļ“µÓ³żČ„±ķĆęµÄŌÓÖŹĄė×Ó²¢½ųŠŠøÉŌļ¼“»ńµĆSrCl2•6H2O£¬
¹Ź“š°øĪŖ£ŗĻ“µÓ”¢øÉŌļ£Ø»ņŗęøÉ£©£»
£Ø4£©n£ØNH4SCN£©=0.2000mol/L”Į0.02L=4.0”Į10-3mol£¬Ag+ŅŌAgSCN°×É«³ĮµķµÄŠĪŹ½Īö³ö£¬ĖłŅŌČÜŅŗÖŠŹ£ÓąµÄAg+µÄĪļÖŹµÄĮæĪŖ£ŗn£ØAg+£©=4.0”Į10-3mol£¬ŌņÓėCl-·“Ó¦µÄAg+µÄĪļÖŹµÄĮæĪŖ£ŗn£ØAg+£©=1.100”Į10-2 mol-4.0”Į10-3mol=7.0”Į10-3mol£¬
1.000g²śĘ·ÖŠSrCl2•6H2OµÄĪļÖŹµÄĮæĪŖ£ŗn£ØSrCl2•6H2O£©=$\frac{1}{2}$”Įn£ØAg+£©=3.5”Į10-3mol£¬
1.000g²śĘ·ÖŠSrCl2•6H2OµÄÖŹĮæĪŖ£ŗm£ØSrCl2•6H2O£©=3.5”Į10-3mol”Į267 g/mol=0.9345g£¬
ĖłŅŌ²śĘ·“æ¶ČĪŖ£ŗ$\frac{0.9435g}{1g}$”Į100%=93.45%£¬
¹Ź“š°øĪŖ£ŗ93.45%£®
µćĘĄ ±¾Ģāæ¼²éÖʱøŹµŃé·½°øµÄÉč¼Ę£¬ĪŖøßĘµæ¼µć£¬°ŃĪÕÖʱøĮ÷³ĢÖŠ·¢ÉśµÄ»Æѧ·“Ó¦¼°ĪļÖŹ·ÖĄė·½·ØĪŖ½ā“šµÄ¹Ų¼ü£¬Éę¼°·“Ó¦ĖŁĀŹ”¢Ńõ»Æ»¹Ō·“Ó¦”¢µĪ¶ØŌĄķµČ£¬×¢ŅāŠÅĻ¢ÓėĖłŃ§ÖŖŹ¶µÄ×ŪŗĻÓ¦ÓĆ£¬×ŪŗĻŠŌ½ĻĒ棬ĢāÄæÄѶČÖŠµČ£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¹Ū²ģŹĒ·ń·¢ÉśĮĖ»ÆŗĻ·“Ó¦ | |
| B£® | ¹Ū²ģŹĒ·ńÓŠŃõĘų²Ī¼Ó·“Ó¦ | |
| C£® | ¹Ū²ģŹĒ·ńÓŠµ„ÖŹ²Ī¼Ó·“Ó¦ | |
| D£® | ¹Ū²ģ·“Ó¦Ē°ŗóŹĒ·ńÓŠŌŖĖŲµÄ»ÆŗĻ¼Ū·¢Éś±ä»Æ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā


²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 ŌŚ2LĆܱÕČŻĘ÷ÄŚ£¬800”ꏱ·“Ó¦£ŗ2NO£Øg£©+O2£Øg£©?2NO2£Øg£©ĢåĻµÖŠ£¬n£ØNO£©Ėꏱ¼äµÄ±ä»ÆČē±ķ£ŗ
ŌŚ2LĆܱÕČŻĘ÷ÄŚ£¬800”ꏱ·“Ó¦£ŗ2NO£Øg£©+O2£Øg£©?2NO2£Øg£©ĢåĻµÖŠ£¬n£ØNO£©Ėꏱ¼äµÄ±ä»ÆČē±ķ£ŗ| Ź±¼ä£Øs£© | 0 | 1 | 2 | 3 | 4 | 5 |
| n£ØNO£©£Ømol£© | 0.020 | 0.01 | 0.008 | 0.007 | 0.007 | 0.007 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
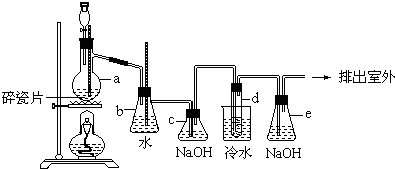
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ±½ŗĶĖÄĀČ»ÆĢ¼ | B£® | ĒāŃõ»ÆÄĘ¹ĢĢåŗĶŹ³ŃĪ | ||
| C£® | ŹÆ»ŅŹÆŗĶÖŲ¾§ŹÆ | D£® | ¾Ę¾«ŗĶĘūÓĶ |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com