
Na2FeO4是一种高效多功能水处理剂,一种制备Na2FeO4的方法可用化学方程式表示如下:2FeSO4+6Na2 O2===2Na2FeO4+2Na2O+2
O2===2Na2FeO4+2Na2O+2 +O2↑。下列对此反应的说法中,不正确的是 ( )
+O2↑。下列对此反应的说法中,不正确的是 ( )
A.方框中的物质为Na2SO4
B.Na2O2既是氧化剂,又是还原剂
C.Na2FeO4既是氧化产物,又是还原产物
D.2 mol FeSO4发生反应时,反应中共转移8 mol电子
 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
下列说法不正确的是( )
A.从实验中测得某种高分子的相对分子质量只能是平均值
B.线型结构的高分子也可以带支链
C.高分子化合物,因其结构不同,溶解性也有所不同
D.高分子化合物一般不易导电是因为相对分子质量大
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中错误的是
A.氧化性;Na+<Mg2+<Al3+ B.半径:C1 >S2
>S2 >F
>F
C.稳定性:HF>HCl>HBr>HI D.酸性:HClO4>H2SO4>H2CO3>H2SiO3
查看答案和解析>>
科目:高中化学 来源: 题型:
亚硝酸(HNO2)在反应中既可作氧化剂,又可作还原剂。当它作氧化剂时,其还原产物可能是( )
①NO ②NO2 ③HNO3 ④N2 ⑤NH3
A.①③ B.①②④
C.①④⑤ D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
已知: NO3-+4H++3e-→NO+2H2O 。现有四种物质:KMnO4、Na2CO3、Cu2O、Fe2(SO4)3,其中能使上述还原过程发生的是 (填化学式),写出该反应化学方程式中氧化产物的化学计量数(写方框内)及其化学式□ 。1mol该物质与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在14.0g银铜合金中加入500mL一定浓度的浓硝酸,合金全部溶解,收集到NO2和NO体积共2.24L(标准状况下),再向该溶液中加入bml,4mol/L的NaOH溶液,刚好使溶液中的阳离子沉淀完全;若将收集到的气体全部与标准状况下的O21.12L充分混合后,通入水中二者刚好完全反应。下列有关说法不正确的的是
A.银的质量为10.8g
B.NO与NO2的体积比之比(相同条件下)为2:1
C.原硝酸的物质的量浓度 (0.1mol+4b×10-3mol)/0.5L
D.沉淀中Cu(OH)2的物质的量为0.05mol
查看答案和解析>>
科目:高中化学 来源: 题型:
1. 52g铜镁合金完全溶解于50mL密度为1.40g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4 的混合气体1120mL (标准状况),向反应后的溶液中加入1.0mol/LNaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀
52g铜镁合金完全溶解于50mL密度为1.40g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4 的混合气体1120mL (标准状况),向反应后的溶液中加入1.0mol/LNaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀 ,下列说法不正确的是
,下列说法不正确的是
A.该合金中铜与镁的物质的量之比是2 ︰1
B.该浓硝酸中HNO3的物质的量浓度是14.0mol/L
C.NO2和N2O4 的混合气体中,NO2 的体积分数是80%
D.得到2.54沉淀时,加入NaOH溶液的体积是600mL
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关离子方程式与所述事实相符且正确的是
A.用惰性电极电解MgCl2溶液:2Cl-+2H2O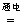 H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
B.向Ba(OH)2溶液中滴加稀硫酸:Ba2++OH-+H++SO42-=BaSO4↓+H2O
C. (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2: Fe2++2OH - =Fe(OH)2
D. C12通入澄清石灰水中:C12+2OH - =C1-+CIO-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
等体积的AlCl3、CaCl2、NaCl三种溶液中Cl- 完全转化为AgCl沉淀,所用0.1mol/L AgNO3 溶液的体积相同,那么这三种溶液的物质的量浓度之比为 ( )
A.1:2:3 B.6:3:2 C.3:2:1 D.2:3:6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com