
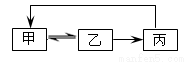
下表中各组物质之间不能通过一步反应实现右图转化的是
| 甲 | 乙 | 丙 |
A | CH2=CH2 | CH3CH2Cl | CH3CH2OH |
B | SiO2 | H2SiO3 | Na2SiO3 |
C | Cl2 | HCl | CuCl2 |
D | AlCl3 | Al(OH)3 | Al2O3 |
科目:高中化学 来源:2013-2014北京市大兴区高三统一练习理综化学试卷(解析版) 题型:选择题
下列图片中的资料对应的说法正确的是
| A | B | C | D |
资料 |
聚乙烯可做 包装材料 |
分类收集垃圾有利于资源的回收利用 |
水果、蔬菜、肉类都含重要的营养物质 |
服用补铁剂同时服用Vc片 |
说法 | 无毒,用于食品、药品包装 | 废旧手机电池放入此标志的垃圾桶 | 柠檬是酸性食品,肉类是碱性食品
| 利用Vc酸性OTC表示非处方药 |
查看答案和解析>>
科目:高中化学 来源:2013-2014北京市东城区高三第二学期综合练习二理综化学试卷(解析版) 题型:选择题
X、Y、Z、Q、W均为短周期元素,原子序数逐渐增大。X、Q同主族,Q元素的焰色反应为黄 色;W的原子半径是同周期中最小的;X与Y、Z分别形成化合物甲、乙,甲、乙均由10电子分子构成,且能反应生成碱。下列说法不正确的是
A.X的单质和Q的单质均可用电解法制得
B.X与Z可形成同时含有极性键和非极性键的化合物
C.Q与W形成的化合物熔化或溶于水时均可发生电离
D.X、Y、Z三种元素形成的化合物一定能抑制水的电离
查看答案和解析>>
科目:高中化学 来源:2013-2014北京市东城区高三二模理综化学试卷(解析版) 题型:简答题
(14分) 2SO2(g)+ O2 (g)  2 SO3 (g)是生产硫酸的主要反应之一。下表是原料气按V(SO2):V(O2):V(N2)=7:11:82投料,在1.01×105Pa时,不同温度下SO2的平衡转化率。
2 SO3 (g)是生产硫酸的主要反应之一。下表是原料气按V(SO2):V(O2):V(N2)=7:11:82投料,在1.01×105Pa时,不同温度下SO2的平衡转化率。
温度/℃ | 400 | 500 | 600 |
SO2转化率/% | 99.2 | 93.5 | 73.7 |
(1)该反应是______反应(填“放热”或“吸热”)。
(2)400℃,1.01×105Pa时,将含10 mol SO2的原料气通入一密闭容器中进行反应,平衡时SO2的物质的量是______mol。
(3)硫酸厂尾气(主要成分SO2、O2和N2)中低浓度SO2的吸收有很多方法。
①用氨水吸收上述尾气,若SO2与氨水恰好反应得到碱性的(NH4)2SO3溶液时,则有关该溶液的下列关系正确的是______(填序号)。
a. c + c(NH3?H2O)= 2[c()+ c()+ c(H2SO3)]
b. c()+ c(H+)= c()+ c()+ c(OH-)
c. c()> c() > c(OH-) > c(H+)
②用 MnO2与水的悬浊液吸收上述尾气并生产MnSO4。
i. 得到MnSO4的化学方程式是______。
ii.该吸收过程生成MnSO4时,溶液的pH变化趋势如图甲,SO2吸收率与溶液pH的关系如图乙。


图甲中pH变化是因为吸收中有部分SO2转化为H2SO4,生成H2SO4反应的化学方程式是______;由图乙可知pH的降低______SO2的吸收(填“有利于”或“不利于”),用化学平衡移动原理解释其原因是______。
查看答案和解析>>
科目:高中化学 来源:2013-2014内蒙古鄂尔多斯市高一下学期期末质量检测化学试卷(解析版) 题型:填空题
(10分)800℃、2L密闭容器反应2NO(g)+O2(g) 2NO2(g)体系中, n(NO)随
2NO2(g)体系中, n(NO)随
时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
计算并回答下列问题:
(1)反应进行到2 s时c (NO)= 。
(2)用O2表示从0~2s内该反应的平均速率υ=___________。
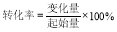 (3) 反应达到平衡状态时NO的转化率= 。(提示 : )
(3) 反应达到平衡状态时NO的转化率= 。(提示 : )
(4)判断一可逆反应是否达到平衡状态的依据有很多,某同学针对该反应提出一种设想:测定容器内气体的密度,当密度不再改变时即可判断出该反应已经达到平衡状态。你认为这种设想是否正确? (填“是”或“否”)请说明你的理由 。
查看答案和解析>>
科目:高中化学 来源:2013-2014内蒙古鄂尔多斯市高一下学期期末质量检测化学试卷(解析版) 题型:选择题
根据下列反应事实:①X+Y2+=X2++Y;②Z+2H2O(冷)=Z(OH)2+H2↑;
③Z2+氧化性比X2+弱;④由Y、W电极组成的电池,电极反应为W2++2e-=W、
Y-2e-=Y2+,可知X、Y、Z、W的还原性由强到弱的顺序为
A.X>Z>Y>W B.Z>W>X>Y C.Z>Y>X>W D.Z>X>Y>W
查看答案和解析>>
科目:高中化学 来源:2013-2014内蒙古赤峰市高三下学期4月统一考试理综化学试卷(解析版) 题型:填空题
(14分)合成氨是人类研究的重要课题,目前工业合成氨的原理为:
合成氨是人类研究的重要课题,目前工业合成氨的原理为:
N2(g)+3H2(g) 2NH3(g)△H=-93.0kJ?mol-1,在3个2L的密闭容器中,使用相同的催化剂,按不同方式投入反应物,分别进行反应:
2NH3(g)△H=-93.0kJ?mol-1,在3个2L的密闭容器中,使用相同的催化剂,按不同方式投入反应物,分别进行反应:
相持恒温、恒容,测的反应达到平衡时关系数据如下:
容器 | 甲 | 乙 | 丙 |
反应物投入量 | 3molH2、2molN2 | 6molH2、4molN2 | 2mol NH3 |
达到平衡的时间/min |
| 6 | 8 |
平衡时 N2的体积密度 | C1 | 1.5 |
|
混合气体密度/g·L-1 |
|
|
|
平衡常数/ L2·mol-2 | K甲 | K乙 | K丙 |
(1)下列各项能说明该反应已到达平衡状态的是 (填写序号字母)
a.容器内H2、N2 、NH3的浓度只比为1:3:2 b.容器内压强保持不变
c. d.混合气体的密度保持不变
d.混合气体的密度保持不变
e.混合气体的平均相对分子质量不变
(2)容器乙中反应从开始到达平衡的反应速度为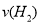 =
=
(3)在该温度下甲容器中反应的平衡常数K (用含C1的代数式表示)
(4)分析上表数据,下列关系正确的是 (填序号):
a. b.氮气的转化率:
b.氮气的转化率: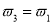 c.
c.  d.
d.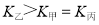
(5)另据报道,常温、常压下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,生成NH3和O2。已知:H2的燃烧热△H=-286KJ/mol,则由次原理制NH3反应的热化学方程式为
(6)希腊阿里斯多德大学的George Mamellos和Michacl Stoukides,发明了一种合成氨的新方法,在常压下,把氢气和用氨气稀释的氮气分别通入一个加热到 的电解池,李勇能通过的氢离子的多孔陶瓷固体作电解质,氢气和氮气在电极上合成了氨,转化率达到78%,在电解法合成氨的过程中,应将N2不断地通入 极,该电极反应式为 。
的电解池,李勇能通过的氢离子的多孔陶瓷固体作电解质,氢气和氮气在电极上合成了氨,转化率达到78%,在电解法合成氨的过程中,应将N2不断地通入 极,该电极反应式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014云南省高二下学期第二次月考化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,2.24L苯中含有的C-H键的数目为0.6NA
B.标准状况下,由H2O2分解制得4.48LO2转移的电子数目为0.8NA
C.14 g 由乙烯与环丙烷(C3H6)组成的混合气体含有的碳原子数目为NA
D.常温下,1 L pH=2的H2SO4溶液中含有的H+数目为0.02NA
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.甲烷、甲醇和甲醛 | B.乙醇、乙烯和丙烯酸 |
| C.甲醇、甲醛和甲酸 | D.甲酸、乙二酸和乙二醇 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com