
【题目】某实验小组用0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液进行中和热的测定,其实验装置如图所示.

(1)写出该反应的热化学方程式(中和热为57.3 kJ·mol-1):___________________________________。
(2)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。请填写下表中的空白:
温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | _____ |
2 | 27.0 | 27.4 | 27.2 | 31.2 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
(3)近似认为0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18 J·g-1·℃-1。则中和热ΔH=________________________(取小数点后一位)。
(4)上述实验数值结果与57.3 kJ·mol-1有偏差,产生偏差的原因可能是____________(填字母)。
a 实验装置保温、隔热效果差
b 量取NaOH溶液的体积时仰视读数
c 分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d 用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
【答案】H2SO4(aq)+2NaOH(aq)===Na2SO4(aq)+2H2O(l) ΔH=-114.6 kJ·mol-1 4.0 -53.5 kJ·mol-1 acd
【解析】
(1)依据中和热是强酸和强碱的稀溶液完全反应生成1mol水放出的热量,标注物质聚集状态和对应焓变写出热化学方程式;
(2)先计算出每次试验操作测定的温度差,然后舍弃误差较大的数据,最后计算出温度差平均值;
(3)根据Q=mc△T计算出反应放出的热量,然后计算出生成1mol水放出的热量,就可以得到中和热;
(4)a.装置保温、隔热效果差,测得的热量偏小;
b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高;
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中,热量散失较多;
d.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高。
(1)中和热为57.3kJmol-1,而中和热是强酸和强碱的稀溶液完全反应生成1mol水放出的热量,稀硫酸和稀氢氧化钠溶液反应的热化学方程式为:H2SO4(aq)+2NaOH(aq)===Na2SO4(aq)+2H2O(l) ΔH=-114.6 kJ·mol-1;
(2)第一次测定温度差为:(30.1-26.1)℃=4.0℃,第二次测定的温度差为:(31.2-27.2)℃=4.0℃,第三次测定的温度差为:(29.8-25.9)℃=3.9℃,第四次测定的温度差为:(30.4-26.3)℃=4.1℃,四次温度差的平均值为4.0℃;
(3)50mL0.50mol/L氢氧化钠与30mL0.50mol/L硫酸溶液进行中和反应,生成水的物质的量为0.05L×0.50mol/L=0.025mol,溶液的质量为:80mL×1g/cm3=100g,温度变化的值为△T=4.0℃,则生成0.025mol水放出的热量为:Q=mc△T=80g×4.18J/(g℃)×4.0℃=1337.6J,即1.3376KJ,所以实验测得的中和热△H=-![]() =-53.5kJ/mol;
=-53.5kJ/mol;
(4)a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,故a正确;
b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高,中和热的数值偏大,故b错误;
c.分多次把NaOH 溶液倒人盛有硫酸的小烧杯中,热量散失较多,测得温度偏低,中和热的数值偏小,故c正确;
d.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高,温度差偏小,测得的热量偏小,中和热的数值偏小,故d正确.
故答案为:acd。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】将20 g NaOH固体溶于水配成100 mL溶液,其密度为1.185 g·mL-1。
(1)该溶液中NaOH的物质的量浓度为______mol·L-1。
(2)从该溶液中取出10 mL,其中NaOH的物质的量浓度为_____ mol· L-1,含NaOH的物质的量为______mol。
(3)将取出的10 mL溶液加水稀释,稀释后溶液中NaOH的物质的量浓度为1 mol·L-1,稀释后溶液体积为___ mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z、Q的原子序数依次增大,c、d、e、f、h是由这些元素组成的二元化合物,自然界中硬度最大的单质和a都由X组成,b由W、Y、Q三种元素组成,d能使品红溶液褪色,e是液体,上述物质的转化关系如图所示(个别产物略去)。下列说法错误的是( )

A.二元化合物沸点:e>d>c
B.简单氢化物的稳定性:Q>Y>X
C.元素的非金属性:Y>X>W
D.原子半径的大小:Z>Q>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室配制500 mL 0.5 mol·L-1的NaCl溶液,有如下操作步骤:
①把称量好的NaCl晶体放入小烧杯中,加适量蒸馏水溶解;
②把①所得溶液小心转入500 mL容量瓶中;
③继续向容量瓶中加蒸馏水至液面距离刻度线l~2 cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面底部,与刻度线相切;
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀;
⑤将容量瓶塞紧,反复上下颠倒摇匀。
请填写下列空白:
(1)实验操作步骤的正确顺序为(填序号) _______________________;
(2)配制过程中使用的仪器除托盘天平、烧杯、玻璃棒、量筒、胶头滴管外,还必须用到的玻璃仪器有 ______________________;
(3)实验中称取NaCl晶体的质量是_________________g;
(4)若出现如下情况,对所配溶液浓度将有何影响?(填“偏高”、“偏低”、“无影响”)
A、定容时俯视 _______________;
B、加蒸馏水时不慎超过了刻度 线________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某密闭容器中,可逆反应:A(g) + B(g)![]() xC(g)符合图中(Ⅰ)所示关系:
xC(g)符合图中(Ⅰ)所示关系:![]() (C)表示C气体在混合气体中的体积分数。由此判断,对图像 (Ⅱ) 说法不正确的是:
(C)表示C气体在混合气体中的体积分数。由此判断,对图像 (Ⅱ) 说法不正确的是:
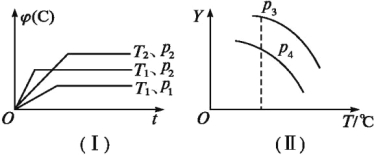
A.p3>p4,Y轴表示A的转化率
B.p3>p4,Y轴表示B的质量分数
C.p3>p4,Y轴表示B的转化率
D.p3>p4,Y轴表示混合气体的平均相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持、加热和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓硝酸 | Cu | NO2 | NaOH溶液 |
B | 浓氨水 | CaO | NH3 | H2O |
C | 稀硝酸 | Cu | NO | H2O |
D | 浓硫酸 | Cu | SO2 | 饱和NaHSO3溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用某些有机物之间的转化可储存太阳能,例如四环烷(QDC)与降冰片二烯(NBD)之间的相互转化,反应过程中的能量变化如图所示。

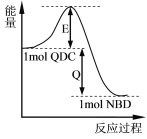
以下叙述中错误的是( )
A.QDC和NBD互为同分异构体
B.相同条件下,NBD比QDC稳定
C.QDC转变为NBD的过程中可以储存太阳能
D.上述转化过程中加入催化剂,对于图中Q的大小没有影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知A、B、C、D、E五种元素的核电荷数依次增大,A原子中p轨道电子数是s轨道电子数的一半;C、D同主族,且D的原子序数是C的2倍;E是第四周期ds区不活泼金属元素。根据以上信息用相应的元素符号填空:
(1)E+核外电子排布式为_______________,DC42-离子的空间构型为_____________________。
(2)ABC三元素第一电离能大小顺序为________________。
(3)D元素在周期表中的位置_______________,能导电的A单质与B、D、E的单质形成的晶体相比较,熔点由高到低的排列顺序是__________________(填化学式)。
(4)已知EDC4溶液中滴入氨基乙酸钠![]() 即可得到配合物G。其结构如图所示:
即可得到配合物G。其结构如图所示:

配合物G中碳原子的轨道杂化类型为_________________________________。
(5)(AB)2的电子式为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关离子共存的说法或离子方程式的书写中,正确的一组是( )
① 加入NaOH溶液后的溶液中能大量共存的离子:NH4+、Al3+、Cl-、SO42-
② pH=1的溶液中能大量共存的离子:Fe3+、Mg2+、Cl-、SO42-
③能使酚酞溶液变红的溶液中能大量共存的离子:K+、CO32-、Na+、S2-
④ 向NH4HCO3溶液中加入足量NaOH溶液并共热:NH4+ + OH— = NH3↑+ H2O
⑤ 用食醋溶解水垢:CaCO3 + 2H+ = Ca2+ + CO2↑+ H2O
⑥ 向硫酸氢钠溶液中滴入氢氧化钡溶液至pH = 7:Ba2+ + 2OH— + 2H+ + SO42— = BaSO4↓ + 2H2O
⑦ 用FeCl3溶液腐蚀铜电路板:2Fe3+ + Cu= 2Fe2+ + Cu2+
A.①③⑤⑦B.②③⑥⑦C.②④⑤⑦D.③④⑥⑦
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com