
| A. | 简单阳离子的氧化性:A<C | |
| B. | 可用含氧酸的酸性比较B、D元素的非金属性 | |
| C. | 简单离子半径:C>D>E>B | |
| D. | A、C、E三种元素形成的化合物既还有离子键又含有共价键 |
分析 A、B、C、D、E为原子序数依次增大的五种短周期元素,A和B、D、E均能形成共价型化合物.A和B形成的化合物在水中呈碱性,则A为H,B为N,氨气的水溶液显碱性,A和C同族,C离子和B离子具有相同的电子层结构,C为Na元素;B和D同族,D为P元素;结合原子序数及C和E形成的化合物在水中呈碱性,可知E为S,以此来解答.
解答 解:由上述分析可知,A为H,B为N,C为Na,D为P,E为S,
A.短周期中金属性Na的最强,则简单阳离子的氧化性:A>C,故A错误;
B.利用最高价含氧酸的酸性比较B、D元素的非金属性,故B错误;
C.电子层越多,离子半径越大,具有相同电子排布的离子中原子序数大的离子半径小,则简单离子半径:D>E>B>C,故C错误;
D.A、C、E三种元素形成的化合物NaHS中,既还有离子键又含有共价键,故D正确;
故选D.
点评 本题考查原子结构、元素周期律,为高频考点,把握元素化合物知识、原子结构、原子序数来推断物质为解答关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 4.08g镁铝合金中含有镁和铝的质量分别为1.92g、2.16g | |
| B. | 生成沉淀的最大质量为10.88g | |
| C. | 若白色沉淀只有Mg(OH)2,该NaOH溶液的浓度至少为0.96mol/L | |
| D. | 溶解4.08 g镁铝合金时,剩余盐酸的物质的量为0.1 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
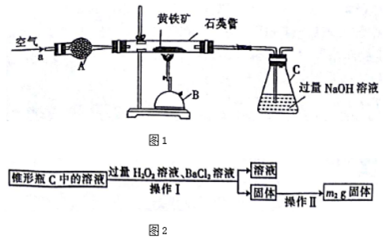
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验操作 | |
| A | 证明乙二酸具有还原性 | 向乙二酸溶液中滴加2 滴KMnO4溶液 |
| B | 制备Fe(OH)3胶体 | 将NaOH溶液滴加到饱和FeCl3溶液中 |
| C | 铝可以从铜盐溶液中置换铜 | 将久置在空气中的铝片放入CuSO4溶液中 |
| D | 检验蔗糖是否水解 | 取蔗糖溶液,加3~5滴稀硫酸,水浴加热5min,取少量溶液,加入银氨溶液加热 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
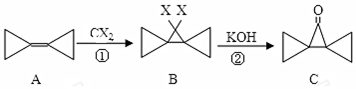
| A. | 反应①是加成反应 | B. | A的所有原子都在一个平面内 | ||
| C. | 反应②是消去反应 | D. | A的二氯代物只有2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验 | 现象 | 结论 |
| A | 向浓度均为0.lmol•L-1NaCl和NaI混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| B | 常温下,测定等物质的量浓度的Na2CO3和Na2SO3溶液的pH值 | 前者的pH值比后者的大 | 非金属性:S>C |
| C | 向某溶液中滴加足量盐酸 | 溶液中出现了气泡和淡黄色浑浊 | 溶液中含有S2-和SO32- |
| D | 向FeCl3和KSCN混合溶液中,加入少量KCl的固体 | 溶液颜色变浅 | FeCl3+KSCN?Fe(SCN)3+3KCl平衡向逆反应方向移动 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com