
����Ŀ��A��һ����Ҫ�Ļ���ԭ�ϣ���֪A��һ��±������Է�������Ϊ92.5����˴Ź���������ֻ��һ���壬C��һ�ָ߷��ӻ����M��һ����Ԫ��״����ת����ϵ��ͼ��ʾ���ش��������⣺
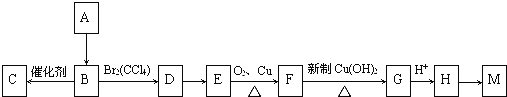
��1��A�ķ���ʽΪ ��A��B�ķ�Ӧ���� ��
��2���л���D�ĽṹʽΪ �� M�Ľṹ��ʽΪ ��
��3��д�����з�Ӧ�Ļ�ѧ����ʽ��B��C�� ��E��F�� ��
��4��д����������������H��ͬ���칹��d�Ľṹ��ʽ ��
����������
���ܷ���������Ӧ��
����������Ʒ�Ӧ�ų����壻
�ܺ˴Ź��������������壬�ҷ������Ϊ6��1��1��
���𰸡���1��C4H9Cl����ȥ��Ӧ��
��2����CH3��2CBr��CH2Br��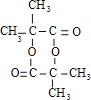 ��
��
��3��n��CH3��2C=CH2![]()
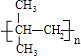 ��
��
2��CH3��2C��OH����CH2OH+O2![]() 2��CH3��2C��OH����CHO+2H2O��
2��CH3��2C��OH����CHO+2H2O��
��4��HCOOC��OH����CH3��2��
��������
���������A��±��������Է�������Ϊ92.5����A�к���1��Clԭ�ӣ�ʣ������ʽ��Ϊ92.5��35.5=57�����������Cԭ����ĿΪ![]() =4��9��������Ϊ��C4H9��A�ķ���ʽΪC4H9Cl����˴Ź���������ֻ��һ���壬��AΪC��CH3��3Cl��Aת���õ�B��Bת��Ϊ�߷��ӻ�����C����B���в����ͼ�����BΪ��CH3��2C=CH2��CΪ
=4��9��������Ϊ��C4H9��A�ķ���ʽΪC4H9Cl����˴Ź���������ֻ��һ���壬��AΪC��CH3��3Cl��Aת���õ�B��Bת��Ϊ�߷��ӻ�����C����B���в����ͼ�����BΪ��CH3��2C=CH2��CΪ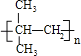 ����CH3��2C=CH2���巢���ӳɷ�Ӧ����DΪ��CH3��2CBr��CH2Br��Dת���õ�E��E����������������G��Ӧ��Dˮ������E����EΪ��CH3��2C��OH����CH2OH��FΪ��CH3��2C��OH����CHO��F��������G��G��õ�H����HΪ��CH3��2C��OH����COOH��GΪ��CH3��2C��OH����COONa��H�����ɻ�������Ӧ����M����MΪ
����CH3��2C=CH2���巢���ӳɷ�Ӧ����DΪ��CH3��2CBr��CH2Br��Dת���õ�E��E����������������G��Ӧ��Dˮ������E����EΪ��CH3��2C��OH����CH2OH��FΪ��CH3��2C��OH����CHO��F��������G��G��õ�H����HΪ��CH3��2C��OH����COOH��GΪ��CH3��2C��OH����COONa��H�����ɻ�������Ӧ����M����MΪ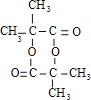 ���ݴ˽��
���ݴ˽��
�⣺A��±��������Է�������Ϊ92.5����A�к���1��Clԭ�ӣ�ʣ������ʽ��Ϊ92.5��35.5=57�����������Cԭ����ĿΪ![]() =4��9��������Ϊ��C4H9��A�ķ���ʽΪC4H9Cl����˴Ź���������ֻ��һ���壬��AΪC��CH3��3Cl��Aת���õ�B��Bת��Ϊ�߷��ӻ�����C����B���в����ͼ�����BΪ��CH3��2C=CH2��CΪ
=4��9��������Ϊ��C4H9��A�ķ���ʽΪC4H9Cl����˴Ź���������ֻ��һ���壬��AΪC��CH3��3Cl��Aת���õ�B��Bת��Ϊ�߷��ӻ�����C����B���в����ͼ�����BΪ��CH3��2C=CH2��CΪ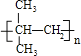 ����CH3��2C=CH2���巢���ӳɷ�Ӧ����DΪ��CH3��2CBr��CH2Br��Dת���õ�E��E����������������G��Ӧ��Dˮ������E����EΪ��CH3��2C��OH����CH2OH��FΪ��CH3��2C��OH����CHO��F��������G��G��õ�H����HΪ��CH3��2C��OH����COOH��GΪ��CH3��2C��OH����COONa��H�����ɻ�������Ӧ����M����MΪ
����CH3��2C=CH2���巢���ӳɷ�Ӧ����DΪ��CH3��2CBr��CH2Br��Dת���õ�E��E����������������G��Ӧ��Dˮ������E����EΪ��CH3��2C��OH����CH2OH��FΪ��CH3��2C��OH����CHO��F��������G��G��õ�H����HΪ��CH3��2C��OH����COOH��GΪ��CH3��2C��OH����COONa��H�����ɻ�������Ӧ����M����MΪ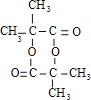 ��
��
��1��������������֪��A�ķ���ʽΪC4H9Cl��A��B��C��CH3��3Cl���������ƴ���Һ�����������·�����ȥ��Ӧ���ɣ�CH3��2C=CH2���ʴ�Ϊ��C4H9Cl����ȥ��Ӧ��
��2��������������֪��DΪ��CH3��2CBr��CH2Br��M�Ľṹ��ʽΪ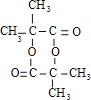 ��
��
�ʴ�Ϊ����CH3��2CBr��CH2Br��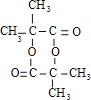 ��
��
��3��B��C�ǣ�CH3��2C=CH2�����Ӿ۷�Ӧ����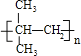 ����Ӧ����ʽΪ��n��CH3��2C=CH2
����Ӧ����ʽΪ��n��CH3��2C=CH2![]()
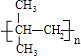 ��
��
E��F�ǣ�CH3��2C��OH����CH2OH���������ɣ�CH3��2C��OH����CHO����Ӧ����ʽΪ��
2��CH3��2C��OH����CH2OH+O2![]() 2��CH3��2C��OH����CHO+2H2O��
2��CH3��2C��OH����CHO+2H2O��
�ʴ�Ϊ��n��CH3��2C=CH2![]()
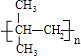 ��
��
2��CH3��2C��OH����CH2OH+O2![]() 2��CH3��2C��OH����CHO+2H2O��
2��CH3��2C��OH����CHO+2H2O��
��4����CH3��2C��OH����COOH��ͬ���칹�����������࣬�ܷ���������Ӧ��Ϊ����������������Ʒ�Ӧ�ų����壬�����Щ�OH������������ͬ���칹���У�HOCH2CH2CH2OOCH��CH3CH��OH��CH2OOCH��CH3CH2CH��OH��OOCH��HCOOC��CH3��CH2OH��HCOOC��OH����CH3��2�������֣����к˴Ź��������������壬�ҷ������Ϊ6��1��1��ͬ���칹��Ľṹ��ʽΪ��HCOOC��OH����CH3��2��
�ʴ�Ϊ��HCOOC��OH����CH3��2��


 �㾦�½̲�ȫ�ܽ��ϵ�д�
�㾦�½̲�ȫ�ܽ��ϵ�д� Сѧ�̲���ȫ���ϵ�д�
Сѧ�̲���ȫ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�˵����ȷ����
A.CaCO3(s) =CaO(s)+CO2(g) �������²����Է����У�˵���÷�Ӧ![]() H��0
H��0
B.ˮ�����ӻ�����Kw �����¶ȵ����߶�����˵��ˮ�ĵ����Ƿ��ȷ�Ӧ
C.0.1mol��L-1Na2CO3��Һ��50��ʱ�ļ��Ա�25��ǿ��˵������ˮ�ⷴӦ�Ƿ��ȷ�Ӧ
D.����FeCl3��Һ�����ù����������г�ּ��ȣ����õ�Fe2O3����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Q��X��Y��ZΪ������Ԫ�أ����������ڱ��е�λ����ͼ��ʾ����4��Ԫ�ص�ԭ������������֮��Ϊ22������˵����ȷ����
![]()
A. Y��ԭ�Ӱ뾶��X�Ĵ�
B. Q������������ˮ��������Ա�Z��ǿ
C. X��Y����3��Ԫ���γɵĻ������ж�ֻ�й��ۼ�
D. Q�ĵ��ʾ��а뵼������ʣ�Q��Z���γɻ�����QZ4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����в��ֶ�����Ԫ�ص����ʻ�ԭ�ӽṹ�����ʾ:
Ԫ�ر�� | Ԫ�����ʻ�ԭ�ӽṹ |
T | M���ϵ�������K���ϵ�������3�� |
X | �����������Ǵ����������2�� |
Y | �����µ���Ϊ˫ԭ�ӷ���,���⻯��ˮ��Һ�ʼ��� |
Z | Ԫ�����������+7�� |
(1)Ԫ��Xλ��Ԫ�����ڱ��ĵ�________����______�壻
(2)Ԫ��Y��ԭ�ӽṹʾ��ͼΪ________��
(3)Ԫ��Z��Ԫ��T���,�ǽ����Խ�ǿ����________(��Ԫ�ط��ű�ʾ),���б�������֤����һ��ʵ����________(�����)��
a.������Z�ĵ��ʺ�T�ĵ���״̬��ͬ
b.Z���⻯���T���⻯���ȶ�
c.һ��������Z��T�ĵ��ʶ���������������Һ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ��������������ԭ�����͵���
��һ����̼�����ж���Ҫ�����ѹ�����Тڶ���������������������ƽ����ϵ����ѹ��С�������ɫ�����ʵ���ҿ����ű���ʳ��ˮ�ķ����ռ�����������ˮ����Һ����������ʱ������Һ���������Ȼ��ع����Ʊ�Na(l)+KCl(l) ![]() K(g)+NaCl(l)
K(g)+NaCl(l)
A.�٢�B.��C.�ۢ�D.�ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ͼ��Ӧ���ǣ� ��




A.���ڴﵽƽ��״̬��N2(g) + 3H2(g) 2NH3(g)��ͼ�ٱ�ʾ��t0ʱ�̳�����һ������NH3��ƽ�������ƶ�
B.��ͼ�ڿ�֪��p2 > p1��T1 > T2���㷴Ӧ��2A(g) + B(g) 2C(g) ��H < 0
C.ͼ�۱�ʾ�ķ�Ӧ����ʽΪ2A = B + 3C
D.���ڷ�Ӧ2X(g) + 3Y(g) 2Z(g) ��H < 0��ͼ��y����Ա�ʾY�İٷֺ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ�ϵͳ���з�ӦC(s)��CO2(g) ![]() 2CO(g)����ʹ��Ӧ�����ӿ��Ĵ�ʩ��
2CO(g)����ʹ��Ӧ�����ӿ��Ĵ�ʩ��
��ͨ����С�����������ѹǿ�� �������¶� �۽�̿���顡 ��ͨ��CO2�� ������̿���� ����������ͨ��N2ʹ��ѹǿ����
A. �٢ڢۢ�B. �٢ڢܢ�C. �٢ڢۢ�D. �٢ڢۢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ס�����ͬѧΪ̽��SO2������Ա���ǿ�����ܷ�Ӧ���ɰ�ɫBaSO3����������ͼ��ʾװ�ý���ʵ��(�г�װ�ú�A�м���װ�����ԣ��������Ѽ���)

ʵ�����������
���� | ���� |
�رյ��ɼУ��μ�һ����Ũ���ᣬ���� | A���а������ɣ�ͭƬ����������� B��������ð��������������ɫ���� C�в�����ɫ������Һ���Ϸ�����dz��ɫ������ʧ |
���ɼУ�ͨ��N2�� ֹͣ���ȣ�һ��ʱ���ر� | |
��B��C�зֱ�ȡ������ɫ��������ϡ���� | ��δ���ְ�ɫ�����ܽ� |
��1��C�а�ɫ������___���ó��������ɱ���SO2����___�ԡ�
��2��C��Һ���Ϸ�����dz��ɫ����Ļ�ѧ����ʽ��___��
��3������B�в�����ϡ����ij���������ԭ����Ϊ�ǿ������뷴Ӧ������Ϊ�ǰ������뷴Ӧ��
��Ϊ֤ʵ���ԵĹ۵㣬��ԭʵ������ϣ�
����ԭ�в���֮ǰ����һ���������ò�����___������A��B������ϴ��ƿD��D��ʢ�ŵ��Լ���___��
�ڽ���ʵ�飬B������
�� | ������ɫ���� |
�� | ������ɫ���� |
�����ɫ���������־�������ϡ���ᡣ������ӷ���ʽ����ʵ��������ͬ��ԭ��___��
��4���ϲ���3������ͬѧ�ķ����������顣B���������ɣ���C�в�����ɫ�������ɴ˵ó��Ľ�����___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ��ij��Һ����ˮ�������c(OH-)=1��10-13mol/L������Һ��һ�����ܴ���������������ǣ� ��
A.NH![]() ��Fe3+��SO
��Fe3+��SO![]() ��Cl-B.CO
��Cl-B.CO![]() ��PO
��PO![]() ��K+��Na+
��K+��Na+
C.Na+��SO![]() ��NO
��NO![]() ��Cl-D.HPO
��Cl-D.HPO![]() ��Na+��HSO
��Na+��HSO![]() ��K+
��K+
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com