
【题目】室温下,向100mL饱和的H2S溶液中通入SO2气体(气体体积换算成标准状况),发生反应:2H2S+SO2=3S↓+2H2O,测得溶液pH与通入SO2的关系如图所示。下列有关说法错误的是( )
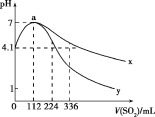
A.a点水的电离程度最大
B.该温度下H2S的Ka1≈10-7.2
C.曲线y代表继续通入SO2气体后溶液pH的变化
D.a点之后,随SO2气体的通入,![]() 的值始终减小
的值始终减小
【答案】D
【解析】
A选项,由题图可知,a点表示通入SO2气体112mL(即0.005mol)时pH=7,说明SO2气体与H2S溶液恰好完全反应,溶液呈中性,a点之前为H2S过量,a点之后为SO2过量,溶液均呈酸性,故a点水的电离程度最大,故A正确;
B选项,由题图中曲线的起点可知,a点溶液呈中性,说明SO2气体与H2S溶液恰好完全反应,由此可知饱和H2S溶液中溶质的物质的量为0.01mol,c(H2S)=0.1mol/L,0.1mol/LH2S溶液电离出的c(H+)=10-4.1 mol/L,电离方程式为H2S![]() H++HS-、HS-
H++HS-、HS-![]() H++S2-;以第一步为主,根据平衡常数表达式计算出该温度下H2S的Ka1≈
H++S2-;以第一步为主,根据平衡常数表达式计算出该温度下H2S的Ka1≈![]() ≈10-7.2,故B正确;
≈10-7.2,故B正确;
C选项,当通入SO2气体336mL时,物质的量为0.015mol,反应后相当于溶液中的c(H2SO3)=0.1mol/L,因为H2SO3的酸性强于H2S,故此时溶液对应的pH应小于4.1,故曲线y代表继续通入SO2气体后溶液pH的变化,故C正确;
D选项,根据平衡常数表达式可知![]() =
=![]() ,a点之后,随SO2气体的通入,c(H+)增大,当通入的SO2气体达饱和时,c(H+)不再变化,故D错误。
,a点之后,随SO2气体的通入,c(H+)增大,当通入的SO2气体达饱和时,c(H+)不再变化,故D错误。
综上所述,答案为D。


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.某研究性学习组利用H2C2O4溶液和酸性KMnO4溶液之间的反应来探究“外界条件改变对化学反应速率的影响”,实验如下:
实验序号 | 实验温度 | KMnO4溶液 | H2C2O4溶液 | H2O | 溶液褪色时间 | ||
V(mL) | C(mol/L) | V(mL) | C(mol/L) | V(mL) | t(s) | ||
A | 293K | 2 | 0.02 | 4 | 0.1 | 0 | t1 |
B | T1 | 2 | 0.02 | 3 | 0.1 | V1 | 8 |
C | 313K | 2 | 0.02 | V2 | 0.1 | 1 | t2 |
(1)通过实验A、B,可探究出_______的改变对反应速率的影响,其中V1=_____,T1=span>_____,通过实验_______可探究出温度变化对化学反应速率的影响。
(2)若t1<8,则由实验A、B可以得出的结论是______________________;利用实验B中数据计算,从反应开始到有结束,用KMnO4的浓度变化表示的反应速率为__________。
(3)该反应中有无色无味气体产生,且锰被还原为Mn2+,写出相应反应的离子方程式_______________。
(4)该小组的一位同学通过查阅资料发现:反应一段时间后该反应速率会加快,造成此种变化的原因是反应体系中的某种粒子对KMnO4与H2C2O4之间的反应有某种特殊的作用,则该作用是_______________,相应的粒子最有可能是(填符号)_______。
Ⅱ.(1)用大苏打(硫代硫酸钠)和硫酸溶液发生反应时溶液变浑浊的时间,也可研究外界条件对化学反应速率的影响。写出相应反应的化学方程式_______。
(2)已知大苏打溶液与Cl2反应时,1mol Na2S2O3转移8mol电子。该反应的离子方程式是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.可以用灼烧后闻气味区别棉花和羊毛
B.油脂水解一定全部生成甘油和高级脂肪酸
C.向蛋白质溶液中加入重金属盐溶液可使蛋白质产生盐析
D.淀粉和纤维素的组成都是![]() ,但淀粉水解纤维素不能水解
,但淀粉水解纤维素不能水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙三种烃分子的结构如图所示,下列有关说法错误的是( )
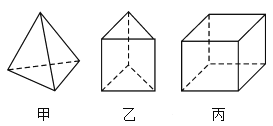
A.1 mol甲分子内含有10 mol共价键
B.由乙分子构成的物质不能发生氧化反应
C.丙分子的二氯取代产物只有三种
D.三者不互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水的电离平衡曲线如图所示:
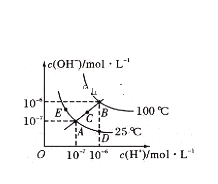
据图回答下列问题:
①图中A、B、C三点处![]() 的大小关系为____________________________________。
的大小关系为____________________________________。
②在A点处,温度不变时,往水中通入适量HCl气体,可以使体系从A点变化到________点。
③在B点处,0.01mol/L的NaOH溶液的pH=_______________。
④在B点处,0.5mol/L ![]() 溶液与1mol/L的KOH溶液等体积混合,充分反应后,所得溶液的pH=__________。
溶液与1mol/L的KOH溶液等体积混合,充分反应后,所得溶液的pH=__________。
⑤在A点处,1g水中含有H+的个数为___________,水的电离平衡常数K与水的离子积![]() 关系为________________。
关系为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将一定浓度的盐酸和醋酸加水稀释,溶液的导电能力随溶液体积变化的曲线如图所示。下列说法中正确的是( )
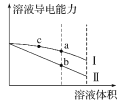
A.两溶液稀释前的浓度相同
B.a、b、c三点溶液的pH由大到小顺序为a>b>c
C.a点的Kw值比b点的Kw值大
D.a点水电离的c(H+)大于c点水电离的c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活息息相关,下列说法不正确的是![]()
A.医用酒精的浓度通常为![]()
B.用食醋可除去热水壶内壁的水垢
C.烹鱼时加适量醋和酒可以增加香味
D.乙烯可作为水果的催熟剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Zn棒和Cu棒用导线连接后,放入某电解质溶液中,构成如图所示装置。试回答下列问题:
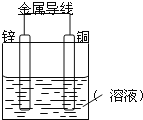
Ⅰ.若电解质溶液为稀硫酸,
(1)Zn棒为原电池的___极,其电极反应式为:___。
(2)Cu棒为原电池的___极,其电极反应式为:___。
Ⅱ.以KOH溶液为电解质溶液,写出甲烷燃料电池的电极反应式
负极反应式:___。
正极反应式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用14.2g无水硫酸钠配制成500 mL溶液,其物质的量浓度为______mol/L。
(2)若配制溶液时操作如图所示,浓度_______(偏高,偏低,不变)。

(3)若从上述溶液(正确配置)中取出10 mL,则这10 mL溶液的物质的量浓度为______mol/L,含溶质的质量为_______g。
(4)若将上述10 mL溶液用水稀释到100 mL,所得溶液中Na+的物质的量浓度为_________mol/L;若将稀释后溶液中的![]() 全部沉淀下来,至少需要加入0.1 mol/L的BaCl2溶液___________mL。
全部沉淀下来,至少需要加入0.1 mol/L的BaCl2溶液___________mL。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com