
用0.10 mol·L-1的盐酸滴定0.10 mol·L-1的氨水,滴定过程中不可能出现的结果是
![]() A.c(NH4+)>c(Cl-),c(OH-)>c(H+)
A.c(NH4+)>c(Cl-),c(OH-)>c(H+)
![]() B.c(NH4+)=c(Cl-),c(OH-)=c(H+)
B.c(NH4+)=c(Cl-),c(OH-)=c(H+)
![]() C.c(Cl-)> c(NH4+), c(OH-)>c(H+)
C.c(Cl-)> c(NH4+), c(OH-)>c(H+)
![]() D.c(Cl-)> c(NH4+),c(H+)> c(OH-)
D.c(Cl-)> c(NH4+),c(H+)> c(OH-)![]()
![]()
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
A.NaHCO3 B.Na2CO3 C.Ca(OH)2 D.NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
![]() (09全国卷)用0.10 mol·L-1的盐酸滴定0.10 mol·L-1的氨水,滴定过程中不可能出现的结果是
(09全国卷)用0.10 mol·L-1的盐酸滴定0.10 mol·L-1的氨水,滴定过程中不可能出现的结果是
![]() A.c(NH4+)>c(Cl-),c(OH-)>c(H+)
A.c(NH4+)>c(Cl-),c(OH-)>c(H+)
![]() B.c(NH4+)=c(Cl-),c(OH-)=c(H+)
B.c(NH4+)=c(Cl-),c(OH-)=c(H+)
![]() C.c(Cl-)> c(NH4+), c(OH-)>c(H+)
C.c(Cl-)> c(NH4+), c(OH-)>c(H+)
![]() D.c(Cl-)> c(NH4+),c(H+)> c(OH-)
D.c(Cl-)> c(NH4+),c(H+)> c(OH-)
查看答案和解析>>
科目:高中化学 来源:2011-2012学年湖南浏阳一中高二下学期第三次阶段性考试化学试卷 题型:实验题
某化学兴趣小组需100 mL某物质的量浓度的FeSO4溶液作标准试剂,现有外观颜色发黄的硫酸亚铁晶体、浓硫酸、稀盐酸、KMnO4溶液、溴水、KSCN溶液、石蕊、酚酞及中学化学常用化学仪器,实验过程如下:
Ⅰ.配制FeSO4溶液
(1)下列关于FeSO4溶液配制操作步骤的合理顺序为________(填字母)。
A.在盛适量水的烧杯中滴加少量浓H2SO4后搅拌均匀并冷却到室温
B.称取一定质量的FeSO4晶体样品
C.将样品溶于已配制的稀H2SO4中,用玻璃棒搅拌至样品充分溶解
D.过滤后,将滤液转移到容量瓶中,加水稀释至指定刻度
E.往硫酸亚铁溶液中加入稍过量的铁粉,充分搅拌,静置一段时间至不再有气体冒出为止
(2)回答下列问题:
①将样品溶于稀H2SO4,而不直接溶于水的理由是__________________________。
②在配制硫酸亚铁溶液时,需加入铁粉的理由是__________________________。
Ⅱ.标定FeSO4溶液的浓度
(1)用移液管量取20.00 mL FeSO4溶液放入锥形瓶中,用0.10 mol·L-1的酸性KMnO4溶液滴至终点,耗去KMnO4溶液20.00 mL,若生成物中Mn元素全部呈+2价,滴定反应的离子方程式为______________,据此可测得FeSO4溶液的物质的量浓度为________mol·L-1。
(2)滴定时选用________(A.石蕊 B.酚酞 C.不用指示剂,填字母)为指示剂,滴定终点颜色变化是_________________________________。
查看答案和解析>>
科目:高中化学 来源:2015届浙江省温州市十校联合体高二上学期期末考试化学试卷(解析版) 题型:实验题
实验室中有一未知浓度的稀盐酸,某学生用0.10 mol·L-1 NaOH标准溶液进行测定盐酸的浓度的实验。取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。请完成下列填空:
|
实验编号 |
待测盐酸的体积(mL) |
NaOH溶液的浓度(mol·L-1) |
滴定完成时,NaOH溶液滴入的体积(mL) |
|
1 |
20.00 |
0.10 |
24.18 |
|
2 |
20.00 |
0.10 |
23.06 |
|
3 |
20.00 |
0.10 |
22.96 |
(1)滴定达到终点的标志是 。
(2)根据上述数据,可计算出该盐酸的浓度约为 (保留小数点后叁位)。
(3)若滴定结束时,碱式滴定管中的液面如图所示,终点读数为 mL。
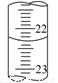
(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有 。
A.用酸式滴定管取20.00 mL待测盐酸,使用前,水洗后未用待测盐酸润洗
B.锥形瓶水洗后未干燥
C.称量NaOH固体时,有小部分NaOH潮解
D.滴定终点读数时俯视
E.碱式滴定管尖嘴部分有气泡,滴定后消失
查看答案和解析>>
科目:高中化学 来源:2011-2012学年福建省宁德市高三毕业班质量检查化学试卷 题型:填空题
(6分)
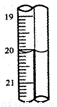
(1)①用1.0 mol·L-1盐酸配制100 mL 0.10 mol·L-1盐酸,所需的玻璃仪器有量筒、
100 mL容量瓶、烧杯、 、 。
②用0.10 mol·L-1标准盐酸滴定未知浓度的烧碱溶液时,酸式滴定管初读教为0.10
mL,终读数如右图所示,则滴定所用盐酸体积为____。
(2)如右图所示,集气瓶内充满某混合气体,置于光亮处一段时间,
将滴管内的水挤入集气瓶,再打开止水夹,烧杯中的水会进入
集气瓶。该集气瓶中的气体可能是 。
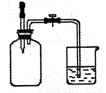
A.CO、O2
B.Cl2、CH4
C.NO2、O2
D.N2、H2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com