
| A.向铁粉中加入足量稀硝酸:2Fe+6H+=2Fe3++3H2↑ |
| B.向AlCl3溶液中滴加浓氨水至过量:Al3++4OH-=AlO2-+2H2O |
| C.向NaIO3溶液中加入适量NaHSO3溶液:IO3-+3HSO3-=I-+3SO42-+3H+ |
| D.向NH4HCO3溶液中滴加过量NaOH溶液:NH4++HCO3-+2OH-=CO32-+NH3·H2O |
科目:高中化学 来源:不详 题型:单选题
| A.NaClNa2SO4 |
| B.NaClNaBrNaINa2SO4 |
| C.NaClNa2SO4I2 |
| D.NaClNaBrNa2SO4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.向苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O→2C6H5OH+CO32- |
| B.用醋酸除去水垢:CaCO3 + 2H+=Ca2+ + H2O + CO2↑ |
| C.用稀硝酸清洗银镜反应实验后的试管:3Ag+4H++NO3-=3Ag++NO↑+2H2O |
| D.钠和冷水反应:Na+2H2O=Na++2OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 第一电离能 | 离子半径 | 熔点 | 酸性 |
| Si S | O2- Na+ | NaCl Si | H2SO4 HClO4 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.为缓解胃酸过多,服含NaHCO3的抗酸药:HCO3-+H+=H2O+CO2↑ |
| B.FeSO4溶液被氧气氧化:4Fe2++O2+2H2O=4Fe3++4OH- |
| C.硫酸铝溶液中加入过量的氨水:Al3++3OH-=Al(OH)3↓ |
| D.将Na2O2加入H2O中:Na2O2+H2O=2Na++2OH-+O2↑ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.用铜作电极电解CuSO4溶液:2Cu2++2H2O电解2Cu+4H++O2↑ |
| B.硅酸钠溶液与醋酸溶液混合:SiO32-+H+=H2SiO3↓ |
| C.H2O2溶液中加入稀硫酸和KI溶液:H2O2+2H++2I-=I2+2H2O |
| D.Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+=SO42-+3S↓+2H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
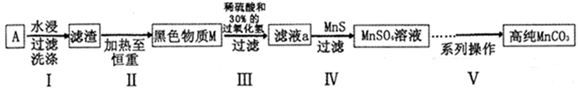
 10-13,Ksp(ZnS)=1.6
10-13,Ksp(ZnS)=1.6 10-24)
10-24)查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
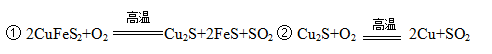

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com