
溴乙烷与氢氧化钾溶液共热,既可生成乙烯又可生成乙醇,其条件区别是( )。
A、生成乙烯的是热的氢氧化钾的水溶液 B、生成乙醇的是热的氢氧化钾的水溶液
C、生成乙烯的是在170℃下进行的 D、生成乙醇的是热的氢氧化钾的醇溶液
科目:高中化学 来源: 题型:
把少量废铁屑溶于过量稀硫酸中,充分搅拌并过滤,在滤液中加入过量的氨水,有红褐色沉淀生成。过滤,加热沉淀物至质量不再发生变化,得到红棕色的残渣。上述沉淀和残渣分别为:
A. Fe(OH)2;FeO B. Fe(OH)3 ;Fe2O3
C. Fe(OH)2、Fe(OH)3、Fe3O4 D. Fe2O3 、Fe(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
现有A、B、C、D、E、F六种短周期主族元素,它们的原子序数依次增大,D与E同主族,且D的氢化物常温时为液态。A、B的最外层电子数之和与C的最外层电子数相等,A分别与B、C、D形成电子总数相等的分子。
(1)C的元素符号是 ;元素F在周期表中的位置 。
 (2)B、D、E元素的氢化物的沸点高低顺序为 > > (用化学式表示)。
(2)B、D、E元素的氢化物的沸点高低顺序为 > > (用化学式表示)。
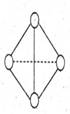
(3)C4气态分子结构如图所示,已知断裂1molC-C吸收l67KJ的热量,
生成lmol C C放出942KJ热量。试写出由C4气态分子变成C2气态分
C放出942KJ热量。试写出由C4气态分子变成C2气态分
子的热化学方程式 。
(4)某盐x (C2A6F2)的性质与CA4F类似,是离子化合物,其水溶液因分
步水解而呈弱酸性。
① 盐x显酸性原因(用离子方程式表示) 。
② 写出足量金属镁加入盐x的溶液中所发生反应的化学方程式
。
(5)E所在周期中原子半径最大的元素与D元素可形成化合物у,酚酞试液遇у先变红后褪色,写出等物质的量的у与FeSO4投入水中恰好完全反应的离子反应方程式
。
查看答案和解析>>
科目:高中化学 来源: 题型:
用乙炔为原料制取CH2Br—CHBrCl,可行的反应途径是 ( )
A.先加Cl2,再加Br2 B.先加Cl2,再加HBr
C.HCl ,再加HBr D.先加HCl ,再加Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
能够鉴定氯乙烷中氯元素的存在的操作是 ( )
A.在氯乙烷中直接加入AgNO3溶液
B.加蒸馏水,充分搅拌后,加入AgNO3溶液
C.加入NaOH溶液,加热后加入稀硝酸酸化,然后加入AgNO3溶液
D.加入NaOH的乙醇溶液,加热后加入AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
酸雨的形成主要是由于( )
A.森林遭到乱砍滥伐,破坏了生态环境
B.含硫化石燃料的大量燃烧和汽车尾气的大量排放
C.大气中二氧化碳的含量增加
D.塑料制品的大量使用
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)维生素C又称为抗坏血酸,在人体内有重要的功能。例如帮助人体将食物中摄取的不易吸收的Fe3+变为易吸收的Fe2+。
这说明维生素C具有______ _ (填氧化性或还原性)
(2)在2 Na2O2 + 2H2O = 4NaOH + O2↑ 反应中,_____ _被氧化, _ 是氧化剂,氧化产物是_______ ,此反应中若转移了2 mol的电子,则产生氧气_____ mol
(3)在3Cu + 8HNO3(稀) = 3Cu(NO3)2 + 2NO↑ + 4H2O的反应中,被还原的元素是 (填元素符号),如有4 mol含该元素的物质参加反应,则转移的电子数目约为__________个。
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的数值,则下列说法中正确的是
A.2.4g金属镁所含电子数目为0.2NA B.1摩尔CH4所含质子数目为10NA
C.标准状况下22.4 LH2O所含分子数目为NA D.18gNH4+所含电子数目为10 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com