


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
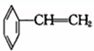 ②
② ③
③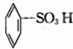 ④
④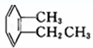 ⑤
⑤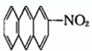
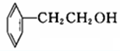 ⑦
⑦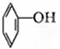 ⑧CH3CH=CH-COOH⑨
⑧CH3CH=CH-COOH⑨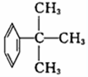
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
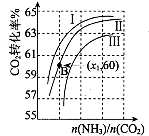 用氨合成尿素的反应为2NH3(g)+CO2(g)?CO(NH2)2(1)+H2O(g).工业生产时,原料气带有水蒸气.图表示CO2的转化率与氨碳比
用氨合成尿素的反应为2NH3(g)+CO2(g)?CO(NH2)2(1)+H2O(g).工业生产时,原料气带有水蒸气.图表示CO2的转化率与氨碳比| n(NH3) |
| n(CO2) |
| n(H2O) |
| n(CO2) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、8.2g Na218O2与足量的CO2和H2O(g)的混合气体充分反应后转移电子数为0.1NA |
| B、1.0L 1.0 mo1/L的NaAlO2水溶液中含有的氧原子数为2NA |
| C、4.0g 金刚砂(SiC)中共含有共用电子对数是0.2NA |
| D、25℃时,pH=13的NaOH溶液中含有OH一的数目为0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com