
| A. | 先加入BaCl2溶液产生白色沉淀,再加入足量稀盐酸沉淀不溶解 | |
| B. | 先加入足量稀盐酸无沉淀,再加入BaCl2溶液产生白色沉淀 | |
| C. | 先加入足量稀硝酸无沉淀,再加入Ba(NO3)2溶液产生白色沉淀 | |
| D. | 先加入Ba(NO3)2溶液无沉淀,再加入足量稀硝酸产生白色沉淀 |
分析 A.氯化银为白色沉淀,无法排除银离子的干扰;
B.加盐酸可排除银离子、碳酸根离子、亚硫酸根离子等干扰;
C.稀硝酸具有强氧化性,可氧化亚硫酸根离子;
D.无法排除亚硫酸根离子的干扰.
解答 解:A.先加入BaCl2溶液,生成氯化银白色沉淀,再加足量的盐酸,沉淀不溶解,不能排除银离子的干扰,也不能肯定白色沉淀为硫酸钡,故A错误;
B.先加稀盐酸,可以排除银离子、碳酸根离子、亚硫酸根离子,再加入BaCl2溶液,产生的沉淀只能是硫酸钡,故B正确;
C.先加入稀硝酸,可将溶液中的亚硫酸根离子氧化成硫酸根离子,再加Ba(NO3)2溶液生成硫酸钡白色沉淀,不能排除亚硫酸根离子的干扰,故C错误;
D.因亚硫酸的酸性比硝酸弱,加入Ba(NO3)2溶液,无沉淀产生,再加稀硝酸,稀硝酸具有氧化性,氧化亚硫酸根离子,产生沉淀为硫酸钡沉淀,所以该操作不能排除亚硫酸根离子的干扰,故D错误;
故选B.
点评 本题考查了硫酸根离子的检验,在检验硫酸根离子时,一定要注意银离子、碳酸根离子、亚硫酸根离子等离子的干扰,所以实验中要注意考虑彼此微粒和物质之间的干扰是解答的关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
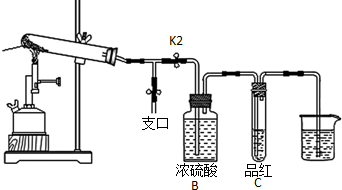
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制碱性Cu(OH)2悬浊液 | B. | FeCl3溶液 | ||
| C. | BaCl2溶液 | D. | 酸性KMnO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有金属元素和非金属元素化合时才能形成离子键 | |
| B. | 单质分子中均存在化学键 | |
| C. | 阴阳离子间通过静电引力而形成的化学键叫做离子键 | |
| D. | 含有共价键的化合物不一定是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子晶体中的每个分子内一定含有共价键 | |
| B. | 金属晶体的熔点和沸点都很高 | |
| C. | 离子晶体中可能含有共价键 | |
| D. | 原子晶体中的相邻原子间只存在非极性共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | R的原子半径在五种原子中最大 | |
| B. | Y的氢化物的稳定性比W的强 | |
| C. | X与Y形成的化合物只有一种 | |
| D. | R的最高价氧化物的水化物的酸性比W的弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com