


科目:高中化学 来源: 题型:
| A、向FeBr2溶液中通入足量的Cl2:2Fe2++Cl2═2Fe3++2Cl- |
| B、向NH4Al(SO4)2溶液中滴入Ba(OH)2恰好使SO42-反应完全2Ba2++4OH-+Al3++2SO42-+NH4+═2BaSO4↓+Al(OH)3↓+NH3.H2O |
| C、向Mg(HCO3)2溶液中加入过量的 NaOH溶液Mg2++2HCO3-+2OH-═MgCO3↓+CO32-+2H2O |
| D、向Fe(NO3)2溶液中加入稀盐酸:3Fe2++4H++NO3-═3Fe3++NO↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
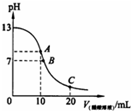 25℃时,在20ml 0.1mol?L-1NaOH溶液中逐滴加入0.2mol?L-1醋酸溶液,曲线如图所示,有关粒子浓度关系的比较中,不正确的是( )
25℃时,在20ml 0.1mol?L-1NaOH溶液中逐滴加入0.2mol?L-1醋酸溶液,曲线如图所示,有关粒子浓度关系的比较中,不正确的是( )| A、在A点:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| B、在B点:c(Na+)=c(CH3COO-),c(OH-)=c(H+) |
| C、在C点:c(Na+)+c(H+)=c(CH3COO-)+c(OH-) |
| D、在C点:c(Na+)=c(CH3COO-)+c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、强电解质和弱电解质的本质区别在于电离程度的不同 |
| B、中性溶液中既没有H+也没有OH- |
| C、pH=4的溶液稀释10000倍,会成为碱性溶液 |
| D、向缓冲溶液中加入少量的酸或碱时,溶液的pH基本不发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
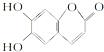
| A、M的相对分子质量是180 |
| B、1 mol M最多能与5 mol Br2发生反应 |
| C、M与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H4O5Na4 |
| D、1 mol M与足量NaHCO3反应能生成2 mol CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
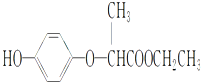
| A、1 mol HPE最多可以和2 mol NaOH反应 |
| B、HPE不能跟浓溴水反应 |
| C、HPE在1H核磁共振谱中有8种峰 |
| D、该物质不能发生在加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知分子式为C12H12的物质A结构简式为如图:已知A的环上的二溴代物有9种同分异构物,由此推断A的环上的四溴代物的异构体的数目有( )
已知分子式为C12H12的物质A结构简式为如图:已知A的环上的二溴代物有9种同分异构物,由此推断A的环上的四溴代物的异构体的数目有( )| A、9种 | B、10种 |
| C、11种 | D、2种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、由反应可确定:氧化性HClO4>HClO |
| B、变蓝的淀粉碘化钾试纸褪色是因为可能发生了:5C12+I2+6H2O=12H++10Cl-+2IO3- |
| C、若氯酸分解所得混合气体,lmol混合气体质量为47.6g,则反应方程式可表示:26HClO3=15O2↑+8C12↑+10HClO4+8H2O |
| D、若化学计量数a=8,b=3,则该反应转移电子数为10e- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com