
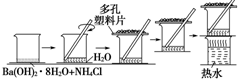
 研究化学反应中的能量变化时,在一只小烧杯里,加入20g已研磨成粉末的Ba(OH)2•8H2O,将小烧杯放在事先已滴有3~4滴水的玻璃片上,然后向烧杯中加入约10g NH4Cl晶体,根据下图所示实验步骤进行操作.回答下列问题:
研究化学反应中的能量变化时,在一只小烧杯里,加入20g已研磨成粉末的Ba(OH)2•8H2O,将小烧杯放在事先已滴有3~4滴水的玻璃片上,然后向烧杯中加入约10g NH4Cl晶体,根据下图所示实验步骤进行操作.回答下列问题:分析 (1)反应为复分解反应,二者反应生成氨气、水以及氯化钡;
(2)通常用湿润的红色石蕊试纸或浓盐酸检验氨气,据此写出检验方法;
(3)混合物成糊状,说明反应中生成了水;根据反应中有氨气生成,氨气有毒,会造成环境污染,需要进行尾气处理.
解答 解:(1)氯化铵属于铵盐,能和强碱氢氧化钡反应生成氨气、水及氯化钡,反应的化学方程式为:Ba(OH)2•8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O,
故答案为:Ba(OH)2•8H2O+2NH4Cl═BaCl2+2NH3↑+10H2O;
(2)该实验中检验氨气的方法有:在烧杯上方放一张湿润的红色石蕊试纸,试纸变蓝,证明有氨气生成,或用蘸有浓盐酸的玻璃棒放在烧杯上方,看到白烟,证明有氨气生成,
故答案为:在烧杯上方放一张湿润的红色石蕊试纸,试纸变蓝,证明有氨气生成(或用蘸有浓盐酸的玻璃棒放在烧杯上方,看到白烟,证明有氨气生成);
(3)反应后移走多孔塑料片观察反应物,混合物成糊状,说明反应中生成了水;
由于反应过程中产生对人体有害的气体氨气,氨气会对环境造成污染,所以应用浸有稀H2SO4的棉花覆盖在多孔塑料片上来吸收产生的氨气,
故答案为:水;用浸有稀硫酸的棉花覆盖在多孔塑料片上来吸收产生的NH3(在通风橱中进行等合理答案也行).
点评 本题考查了探究化学反应与能量变化的关系,题目难度中等,注意掌握化学反应与能量变化的关系,明确探究吸热反应、放热反应的方法,试题培养了学生的分析能力及化学实验能力.


 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 烷烃的通式为CnH2n+2,随n值增大,碳元素的质量百分含量逐渐减小 | |
| B. | 乙烯与溴发生加成反应的产物为溴乙烷 | |
| C. | 1 mol 苯恰好与3 mol氢气完全加成,说明一个苯分子中有三个碳碳双键 | |
| D. | n=7,主链上有5个碳原子烷烃共有五种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,1.0L pH=13的Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| B. | 标准状况下,2.24L Cl2与过量稀NaOH溶液反应,转移的电子总数为0.2NA | |
| C. | 室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA | |
| D. | 标准状况下,22.4L 甲醇中含有的氧原子数为1.0NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | M | N | R | Q | |
| 原子半径(×10-10m) | 1.86 | 0.99 | 1.43 | 1.60 | 1.02 | 0.75 | 0.74 | |
| 主要化合价 | 最高正价 | +1 | +7 | +3 | +2 | +6 | +5 | -- |
| 最低负价 | -- | -1 | -- | -- | -2 | -3 | -2 | |
| A. | 气态氢化物的稳定性:N>Y | |
| B. | M(OH)2的碱性比XOH的碱性强 | |
| C. | 元素X和Q形成的化合物只可能有离子键 | |
| D. | X、Z、N的最高价氧化物对应的水化物之间可两两相互反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某汽车尾气分析仪以燃料电池为工作原理测定CO的浓度,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动.下列说法不正确的是( )
某汽车尾气分析仪以燃料电池为工作原理测定CO的浓度,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动.下列说法不正确的是( )| A. | 工作时电极b作正极,O2-由电极b流向电极a | |
| B. | 负极的电极反应式为:CO+O2--2e-═CO2 | |
| C. | 当传感器中通过2×10-3 mol电子时,通过的尾气中含有2.24 mL CO | |
| D. | 传感器中通过的电流越大,尾气中CO的含量越高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2 | 20 | |
| Ⅱ | 2 | 20 | 10滴饱和X溶液 |
| Ⅲ | 2 | 30 | |
| Ⅳ | 1 | 20 | 1 mL蒸馏水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
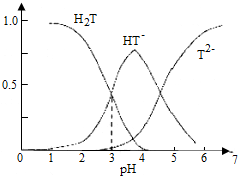
| A. | 葡萄酒中除了存在酒石酸外,还存在酒石酸盐 | |
| B. | 常温下,H2T?H++HT- Ka=10-3 | |
| C. | 当葡萄酒的pH为3.7时,HT-所占分数达到最大,此时葡萄酒中H2T>T2- | |
| D. | 当HT-和T2-物质的量浓度相等时,溶液中水电离出来的氢离子浓度小于纯水中氢离子的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在一定温度下的BaSO4水溶液中,Ba2+和SO42-浓度的乘积是一个常数 | |
| B. | 向含有BaSO4固体的溶液中加入适量的水使溶解又达到平衡时,BaSO4的溶度积不变,其溶解度也不变 | |
| C. | 只有难溶电解质才存在沉淀溶解平衡过程 | |
| D. | 向饱和的BaSO4水溶液中加入硫酸,BaSO4的Ksp变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ③ | C. | ①② | D. | 全是 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com