
【题目】(1) 已 知 16 g 固 体 硫 完 全 燃 烧 时 放 出 148.4 kJ的 热 量 , 该 反 应 的 热 化 学 方 程 式 是________________。
(2)2mol乙醇 燃烧 时,生成液 态水 和二 氧化碳 ,同 时放 出 2733.6kJ 的热 量, 写出 该反应 的热 化学 方程式________________________________。
(3)用 NA 表示阿伏加德罗常数,在 C2H2(气态)完全燃烧生成 CO2 和液态水的反应中,每有 5NA 个电子转移时,放出650 kJ 的热量。其燃烧热的热化学方程式为_____。
(4).在一定条件下,通入 80 g SO2 气体充分生成 SO3 气体时,放 出热量 98.3 kJ,已知 SO2 在此条件下转化率为 80%,则该反应的热化学方程________________________________。
(5)已知:CO(g)+H2O(g)=CO2(g)+H2(g) △H2=bkJ/mol;CO2 (g) +3H2(g)=CH3OH(g)+ H2O(g) △H3=c kJ/mol;2CH3OH(g)= CH3OCH3(g) + H2O(g) △H4=d kJ/mol
求:2CO(g) + 4H2 (g)=CH3OCH3(g) + H2O(g) △H=_____kJ/mol
【答案】S(s)+ O2(g)=SO2(g) ΔH= -296.8kJ/mol 2C2H5OH(l)+6O2(g)= 4CO2(g)+6 H2O(l) △H=-2733.6 kJ/mol C2H2(g)+ ![]() O2(g)= 2CO2(g)+ H2O(l) △H=-1300 kJ/mol 2SO2(g)+ O2(g)= 2SO3(g) ΔH= -196.6 kJ/mol △H= (d+2b+2c)kJ/mol
O2(g)= 2CO2(g)+ H2O(l) △H=-1300 kJ/mol 2SO2(g)+ O2(g)= 2SO3(g) ΔH= -196.6 kJ/mol △H= (d+2b+2c)kJ/mol
【解析】
(1)16 g固体硫是0.5mol,所以求出1mol固体硫燃烧放出的热量;
(2) 1mol 乙醇(C2H5OH)完全燃烧并生成二氧化碳和液态水时,放出热量为:2733.6kJ;
(3)依据反应2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l),可知,每2摩尔乙炔参加反应,转移20mol电子,现有5NA个电子转移时,放出650kJ的热量,则1mol乙炔反应时可放出1300kJ的热量;
(4)在一定条件下,80g SO2气体物质的量为1.25mol,通入密闭容器中被氧化成SO3气体,已知 SO2 在此条件下转化率为 80%,则生成SO3气体(1.25×80%)mol=1mol,达到平衡时,共放出热量98.3kJ,则1mol二氧化硫完全反应放热=98.3kJ;
(5) ①CO(g)+H2O(g)=CO2(g)+H2(g) △H2=bkJ/mol;②O2 (g) +3H2(g)=CH3OH(g)+ H2O(g) △H3=c kJ/mol;③2CH3OH(g)= CH3OCH3(g) + H2O(g)△ H4=d kJ/mol;则①×2+②×2+③可以得到2CO(g) + 4H2 (g)=CH3OCH3(g) + H2O(g)。
(1)16 g固体硫是0.5mol,所以反应燃烧的热化学方程式是S(s)+O 2 (g)=SO 2 (g) ΔH=2×(-148.4 kJ/mol)= -296.8kJ/mol;
(2) 1mol 乙醇(C2H5OH)完全燃烧并生成二氧化碳和液态水时,放出热量为:2733.6kJ,所以该反应的热化学方程式为:2C2H5OH(l)+6O2(g)= 4CO2(g)+6 H2O(l) △H=-2733.6 kJ/mol;
(3)依据反应2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l),可知,每2摩尔乙炔参加反应,转移20mol电子,现有5NA个电子转移时,放出650kJ的热量,则1mol乙炔反应时可放出1300kJ的热量,所以此反应燃烧热的热化学方程式为:C2H2(g)+ ![]() O2(g)= 2CO2(g)+ H2O(l) △H=-1300 kJ/mol;
O2(g)= 2CO2(g)+ H2O(l) △H=-1300 kJ/mol;
(4)在一定条件下,80g SO2气体物质的量为1.25mol,通入密闭容器中被氧化成SO3气体,已知 SO2 在此条件下转化率为 80%,则生成SO3气体(1.25×80%)mol=1mol,达到平衡时,共放出热量98.3kJ,则1mol二氧化硫完全反应放热=98.3kJ,反应的热化学方程式为:2SO2(g)+ O2(g)= 2SO3(g) ΔH= 2×(-98.3)kJ/mol = -196.6 kJ/mol;
(5) ①CO(g)+H2O(g)=CO2(g)+H2(g) △H2=bkJ/mol;②O2 (g) +3H2(g)=CH3OH(g)+ H2O(g) △H3=c kJ/mol;③2CH3OH(g)= CH3OCH3(g) + H2O(g) △H4=d kJ/mol;则①×2+②×2+③可以得到2CO(g) + 4H2 (g)=CH3OCH3(g) + H2O(g) △H= (d+2b+2c) kJ/mol。


科目:高中化学 来源: 题型:
【题目】下列说法或表示方法中正确的是( )
A.HCl和NaOH反应的中和热ΔH=-57.3kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热ΔH=-2×57.3kJ·mol-1
B.101kPa时,H2的热值为142.75kJ·g-1,则表示氢气标准燃烧热的热化学方程式为:H2(g)+![]() O2(g)=H2O(l) ΔH=-142.75kJ·mol-1
O2(g)=H2O(l) ΔH=-142.75kJ·mol-1
C.由C(金刚石)=C(石墨) ΔH=-1.9kJ·mol-1可知,金刚石比石墨稳定
D.同温同压下,4Al(s)+3O2(g)=2Al2O3(s)在常温和点燃条件下的ΔH相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述不正确的是
A.冰醋酸中逐滴加水,则溶液的导电性和醋酸的电离程度均先增大后减小
B.若根据反应“![]() ”设计成燃料电池,既可发电同时还可用于制备盐酸
”设计成燃料电池,既可发电同时还可用于制备盐酸
C.可逆反应的正、逆反应平衡常数数值互为倒数
D.电镀铜时,纯铜做阳极,电镀液为![]() 溶液
溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]()
![]() 。在
。在![]() 的密闭容器中进行模拟合成实验,将
的密闭容器中进行模拟合成实验,将![]() 和
和![]() 通入容器中,分别在
通入容器中,分别在![]() 和
和![]() 反应,每隔一段时间测得容器中的甲醇的浓度如下:
反应,每隔一段时间测得容器中的甲醇的浓度如下:
| 10 | 20 | 30 | 40 | 50 | 60 |
300 | 0.40 | 0.60 | 0.75 | 0.84 | 0.90 | 0.90 |
500 | 0.60 | 0.75 | 0.78 | 0.80 | 0.80 | 0.80 |
下列说法正确的是 ![]()
![]()
A.![]() 时,开始
时,开始![]() 内
内![]() 的平均反应速率
的平均反应速率![]()
B.反应达到平衡时,两温度下CO和![]() 的转化率之比均为
的转化率之比均为![]()
C.![]() 反应达到平衡时,放出的热量为
反应达到平衡时,放出的热量为![]()
D.![]() 时,若容器的容积压缩到原来的
时,若容器的容积压缩到原来的![]() ,则
,则![]() 增大,
增大,![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
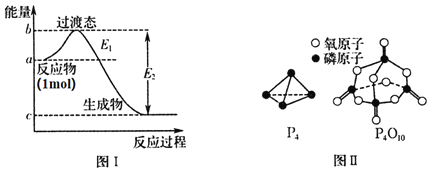
【题目】磷及其化合物在化工生产中有着广泛的应用,请对下列问题作答。
![]() 有多种单质,其中一种叫白磷,分子式为
有多种单质,其中一种叫白磷,分子式为![]() ,结构如图Ⅱ所示,
,结构如图Ⅱ所示,![]() 分子的活泼性比
分子的活泼性比![]() 分子______
分子______![]() 填强或弱
填强或弱![]() 。
。
![]() 白磷燃烧的能量变化图和产物结构如图Ⅰ、图Ⅱ所示,假设
白磷燃烧的能量变化图和产物结构如图Ⅰ、图Ⅱ所示,假设![]() 、
、![]() 、
、![]() 的键能分别为x、y、z,x、y、z、a、b、c均为正值,利用图中信息求出
的键能分别为x、y、z,x、y、z、a、b、c均为正值,利用图中信息求出![]() 的键能的表达式为______
的键能的表达式为______
![]() 已知含氧酸分子中只有羟基中的氢原子才能发生电离。
已知含氧酸分子中只有羟基中的氢原子才能发生电离。![]() 具有较强还原性而且该酸无酸式盐,分子中只含一个羟基,写出其电离方程式______
具有较强还原性而且该酸无酸式盐,分子中只含一个羟基,写出其电离方程式______
![]() 可用于化学镀镍。配平并完成下列化学方程式:
可用于化学镀镍。配平并完成下列化学方程式:
______![]() ______
______![]() ______
______![]() ______
______![]() ______
______![]() ______
______
![]() 磷酸是一种三元中强酸,已知
磷酸是一种三元中强酸,已知![]() ,
,![]() ,
,![]() ,
,![]() 的水溶液显______性,解释原因______。
的水溶液显______性,解释原因______。
![]() 是重要的化工原料,某温度下,反应
是重要的化工原料,某温度下,反应![]() 的化学平衡常数
的化学平衡常数![]() ,在1L的密闭容器中加入
,在1L的密闭容器中加入![]() ,平衡后
,平衡后![]() 的浓度是______。
的浓度是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】举世闻名的侯氏制碱法的工艺流程如下图所示,下列说法正确的是( )

A.往母液中加入食盐的主要目的是使![]() 更多的析出
更多的析出
B.从母液中经过循环Ⅰ进入沉淀池的主要是![]() 、
、![]() 和氨水
和氨水
C.沉淀池中反应的化学方程式:![]()
D.设计循环Ⅱ的目的是使原料氯化钠的利用率大大提升
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用自然界存在的角膜硼镁矿![]() 主要成分为
主要成分为![]() 制取金属镁和粗硼,工艺过程如下:
制取金属镁和粗硼,工艺过程如下:
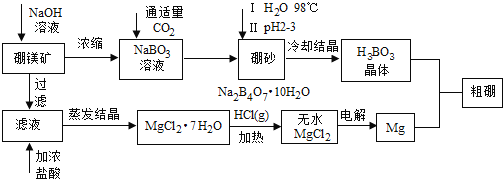
根据以上信息回答下列问题:
(1)硼砂中硼的化合价 ______ ,溶于热水后,若需要调节pH为![]() 制取硼酸,写出该反应的离子方程式: ______ 。
制取硼酸,写出该反应的离子方程式: ______ 。
(2)从氯化镁晶体制得无水氯化镁的条件是 ______ ;其理由是 ______ ,若用惰性电磁电解![]() 溶液,写出电解过程的离子方程式: ______ 。
溶液,写出电解过程的离子方程式: ______ 。
(3)制得的粗硼可在一定条件与![]() 作用生产
作用生产![]() ,再提纯
,再提纯![]() ,
,![]() 沸点较低,提纯可采用 ______ ;高温时
沸点较低,提纯可采用 ______ ;高温时![]() 即可分解,得到高纯度硼。根据分解生成碘的量还可以测定粗硼的粗度。方法如下:
即可分解,得到高纯度硼。根据分解生成碘的量还可以测定粗硼的粗度。方法如下:
称取![]() 粗硼转化成纯
粗硼转化成纯![]() ,再完全分解,生成的碘用
,再完全分解,生成的碘用![]() 的
的![]() 溶液滴定至终点,消耗标准液
溶液滴定至终点,消耗标准液![]() 滴定原理:
滴定原理:![]()
①滴定终点判断应用 ______ 作指示剂;
②标准液应盛装在 ______ 滴定管中;
③该粗硼的纯度为 ______ 。
(4)![]() 酸性染料电池的反应机理为:
酸性染料电池的反应机理为:![]() ,则电池正极反应式为 ______ ;常温下,若起始电解液
,则电池正极反应式为 ______ ;常温下,若起始电解液![]() ,则电池工作一段时间后,电解液
,则电池工作一段时间后,电解液![]() ,此时溶液中
,此时溶液中![]() ______ ;当溶液
______ ;当溶液![]() 时,镁元素的主要存在形式是 ______ 。
时,镁元素的主要存在形式是 ______ 。![]() 已知:
已知:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置中,小试管内为红墨水,带有支管的U型管中盛有pH=4的雨水和生铁片。经观察,装置中有如下现象:开始时插在小试管中的导管内的液面下降,一段时间后导管内的液面回升,略高于U型管中的液面。以下有关解释合理的是

A.生铁片中的碳是原电池的负极,发生还原反应
B.雨水酸性较强,生铁片始终发生析氢腐蚀
C.墨水液面回升时,正极反应式为:O2+2H2O+4e-===4OH-
D.U型管中溶液pH逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢卤酸的能量关系如图所示下列说法正确的是

A. 已知HF气体溶于水放热,则HF的△H1<0
B. 相同条件下,HCl的△H2比HBr的小
C. 相同条件下,HCl的△H3+△H4比HI的大
D. 一定条件下,气态原子生成1molH-X键放出akJ能量,则该条件下△H2=+akJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com