
分析 结合题干条件列出平衡三段式,
2SO2 +O2 =2SO3
起始量(mol) 2 3 0
变化量(mol)1.5 0.75 1.5
平衡量(mol)0.5 2.25 1.5
(1)浓度c=$\frac{n}{V}$,二氧化硫的反应速率V=$\frac{△c}{△t}$;
(2)依据上述三段式计算,三氧化硫物质的量分数=$\frac{三氧化硫物质的量}{平衡混合气体总物质的量}$×100%.
解答 解:经过10min反应达平衡,有1.5mol SO2发生了反应,则
2SO2 +O2 =2SO3
起始量(mol) 2 3 0
变化量(mol)1.5 0.75 1.5
平衡量(mol)0.5 2.25 1.5
(1)达到平衡时,O2的物质的量浓度c=$\frac{n}{V}$=$\frac{2.25mol}{2L}$=1.125mol/L,二氧化硫的反应速率V=$\frac{△c}{△t}$=$\frac{\frac{1.5mol}{2L}}{10min}$=0.075mol/L•min,
故答案为:1.125;0.075;
(2)三氧化硫物质的量分数=$\frac{三氧化硫物质的量}{平衡混合气体总物质的量}$×100%=$\frac{1.5}{0.5+2.25+1.5}$×100%=35.3%,
故答案为:35.3%.
点评 本题考查了化学平衡计算的方法,主要是三段式列式,掌握概念实质和计算方法是解题关键,题目较简单.


科目:高中化学 来源: 题型:选择题
 2015年4月在漳州市发生了PX爆炸事件,PX的成分“对二甲苯”,其结构式如图所示:,下列关于PX的叙述中,不正确的是( )
2015年4月在漳州市发生了PX爆炸事件,PX的成分“对二甲苯”,其结构式如图所示:,下列关于PX的叙述中,不正确的是( )| A. | PX是一种有机化合物 | |
| B. | 仅由碳、氢两种元素组成 | |
| C. | 爆炸燃烧的产物是可能是CO2和H2O | |
| D. | 该有机化合物分子中存在碳碳单键,也存在碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3( CH2)2 CH3 和 CH3 CH=CH CH3 | |
| B. | CH3( CH2)2 CH3 和 CH3 CH2 CH( CH3) CH2 CH3 | |
| C. | CH3 C≡C CH3 和CH2=CH CH=CH2 | |
| D. | CH3 C≡C CH3 和 CH3 CH=CH CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
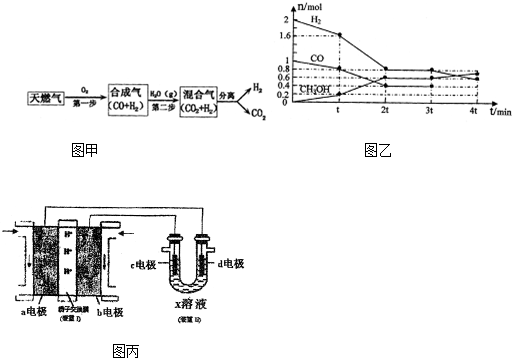
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:Fe2+、NO3-、SO42-、Na+ | |
| B. | 由水电离出的c(H+)=1×10-14mol/L的溶液中:Ca2+、Cl-、HCO3-、K+ | |
| C. | c(H+)/c(OH-)=1×1012的溶液中:NH4+、Cl-、NO3-、Al3+ | |
| D. | c(Fe3+)=0.1 mol/L的溶液中:K+、ClO-、SO42-、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24 L CCl4所含的原子数为0.5 NA | |
| B. | 标准状况下0.5mol NO和0.5mol O2组成的混合气体的体积约为22.4L | |
| C. | 78 g Na2O2 与足量水反应转移电子数为NA | |
| D. | 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
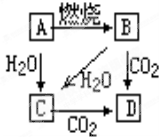 如图中,A是单质,B为淡黄色固体.写出下列转化的化学方程式:
如图中,A是单质,B为淡黄色固体.写出下列转化的化学方程式:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向溴化亚铁溶液中通入少量氯气:2Fe2++Cl2═2Fe3++2Cl- | |
| B. | 苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O-→2C6H5OH+CO32- | |
| C. | 向硫酸氢钠溶液中滴入氢氧化钡溶液至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O | |
| D. | 将氢氧化铁粉末加入氢碘酸中:Fe(OH)3+3H+═Fe3++3H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com