
| A. | 周期表从左到右,元素的电负性逐渐变大 | |
| B. | 周期表从上到下,元素的电负性逐渐变大 | |
| C. | 电负性越大,金属性越强 | |
| D. | 电负性越小,非金属性越强 |
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 1mol甲醇中含有C-H键的数目为4NA | |
| B. | 标准状况下,22.4L CCl4含有个NA个CCl4分子 | |
| C. | 2.3g甲苯和丙三醇(C3H8O3)的混合物中,含氢原子数目为0.2NA | |
| D. | 标准状况下,2.24 L溴乙烷中含共价键数目为0.7NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+、OH-、Al3+、SO42- | B. | Fe3+、SCN-、Na+、Cl- | ||
| C. | Mg2+、SO42-、Na+、Cl- | D. | H+、Cl-、NO3-、Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
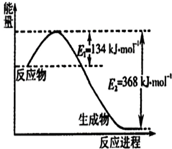 碳是地球上含量丰富的元素,其氧化物的研究有着重要意义.
碳是地球上含量丰富的元素,其氧化物的研究有着重要意义.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲醇、乙二醇、丙三醇都易溶于水且都有剧毒 | |
| B. | 按甲醇、乙二醇、丙三醇的顺序,其沸点逐渐升高 | |
| C. | 相同质量的甲醇、乙二醇、丙三醇与足量钠反应,甲醇放出氢气最多 | |
| D. | 甲醇、乙二醇、丙三醇都能发生取代、消去、氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
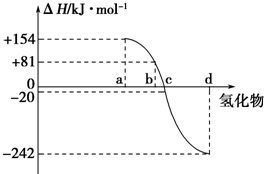 (1)已知2mol氢气燃烧生成液态水时放出572kJ热量,反应方程式是2H2(g)+O2(g)═2H2O(l)
(1)已知2mol氢气燃烧生成液态水时放出572kJ热量,反应方程式是2H2(g)+O2(g)═2H2O(l)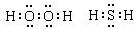 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 过程①中除去粗盐中的SO、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为:Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸 | |
| B. | 步骤④的作用是达到富集溴的目的 | |
| C. | 过程②中MgCl2•6H2O加热脱水制得无水MgCl2 | |
| D. | 工业上电解熔融精盐的过程称为氯碱工业 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com