
分析 (1)二氧化硫与水反应生成亚硫酸,亚硫是二元弱酸,能分步电离;
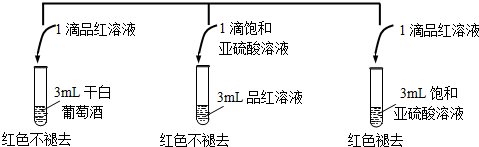
(2)干白葡萄酒不能使品红溶液褪色的可能原因是干白葡萄酒中二氧化硫或亚硫酸含量太少;
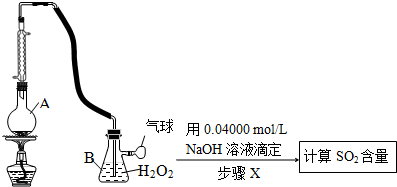
(3)根据装置图可知仪器名称;
(4)二氧化硫与双氧水发生氧化还原反应生成硫酸;
(5)双氧水在二氧化锰作催化剂的条件下发生分解反应生成水和氧气;
(6)二氧化硫被氧化成硫酸,用过量的氢氧化钠中和,剩余的氢氧化钠用盐酸滴定,根据盐酸的物质的量及氢氧化钠的总物质的量可计算出与硫酸反应的氢氧化钠的物质的量,进而得出硫酸的物质的量,根据硫元素守恒计算二氧化硫及酒中的二氧化硫的含量;由于盐酸易挥发,有部分氯化氯会挥发到B装置中,所以会使氢氧化钠的用量偏多,据此分析.
解答 解:(1)二氧化硫与水反应生成亚硫酸,亚硫是二元弱酸,能分步电离,涉及的平衡方程式为SO2(g)?SO2(aq)、SO2+H2O?H2SO3、H2SO3?H++HSO3-、HSO3-?H++SO32-,
故答案为:SO2(g)?SO2(aq)、SO2+H2O?H2SO3、H2SO3?H++HSO3-、HSO3-?H++SO32-;
(2)干白葡萄酒不能使品红溶液褪色的可能原因是干白葡萄酒中二氧化硫或亚硫酸含量太少,
故答案为:干白中二氧化硫或亚硫酸含量太少;
(3)根据装置图可知仪器A名称为圆底烧瓶,
故答案为:圆底烧瓶;
(4)二氧化硫与双氧水发生氧化还原反应生成硫酸,反应的方程式为SO2+H2O2═H2SO4,
故答案为:SO2+H2O2═H2SO4;
(5)双氧水在二氧化锰作催化剂的条件下发生分解反应生成水和氧气,所以除去H2O2的方法是加入二氧化锰并振荡,
故答案为:加入二氧化锰并振荡;
(6)根据2NaOH~H2SO4~SO2可知SO2的质量为:$\frac{1}{2}$×(0.0400mol/L×0.025L)×64g/mol=0.032g,该葡萄酒中的二氧化硫含量为:$\frac{0.032g}{0.1L}$=0.32g/L,由于盐酸易挥发,有部分氯化氯会挥发到B装置中,所以会使氢氧化钠的用量偏多,所以会导致测定结果比实际值偏高,
故答案为:0.32;盐酸的挥发造成的干扰.
点评 本题考查了探究物质的组成、测量物质的含量的方法,题目难度中等,试题涉及了二氧化硫性质、中和滴定的计算,要求学生掌握探究物质组成、测量物质含量的方法,明确二氧化硫的化学性质及中和滴定的操作方法及计算方法,试题培养了学生灵活应用所学知识的能力.


 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:解答题
| 化学键 | C-C | C-H | Si-Si | Si-H |
| 键能(KJ/mol) | 356 | 413 | 226 | 318 |
| 氟化物 | NaF | MgF2 | SiF4 |
| 熔点/K | 1266 | 1534 | 183 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属性:X<Y | |
| B. | 原子半径:Y>Z | |
| C. | 最简单氢化物的热稳定性:Z>W | |
| D. | Y元素氧化物不溶于X元素最高价氧化物对应水化物的水溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 实验操作 | 实验目的 |
| A | 在浓硫酸和稀硫酸中分别加入Cu片,加热 | 比较稀、浓硫酸氧化性强弱 |
| B | F2、Cl2分别与H2反应 | 比较氟、氯的非金属性强弱 |
| C | 把CO2通入到水玻璃中 | 比较碳、硅的非金属性强弱 |
| D | 向MgCl2、AlCl3溶液中分别通入NH3 | 比较镁、铝金属性强弱 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝片不用特殊方法保护 | |
| B. | 轮船水线下的船体上装一定数量的锌块 | |
| C. | 纯锌与稀硫酸反应时,滴入少量CuSO4溶液后速率增大 | |
| D. | 镀锌铁比较耐用 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 分子式为C7H16,主链上有2个支链的烷烃共有5种同分异构体 | |
| B. | 异丙醇与NaOH醇溶液共热生成化合物的分子式为:C3H6 | |
| C. | 甘氨酸、丙氨酸和苯丙氨酸脱水,最多可生成9种二肽 | |
| D. | 用酸性KMnO4溶液可鉴别2-丁烯和正丁醛 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 77 | B. | 95 | C. | 172 | D. | 249 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com