
NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:
 (1)NH4Al(SO4)2可作净水剂,其原理是___________________________
(1)NH4Al(SO4)2可作净水剂,其原理是___________________________
_
(用必要的化学用语和相关文字说明)。
(2)相同条件下,0.1 mol·L-1 NH4Al(SO4)2溶液中c(NH )________(填“等于”、“大于”或“小于”)0.1 mol·L-1 NH4HSO4溶液中c(NH
)________(填“等于”、“大于”或“小于”)0.1 mol·L-1 NH4HSO4溶液中c(NH )。
)。
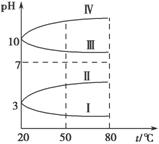
(3)均为0.1 mol·L-1的几种电解质溶液的pH随温度变化的曲线如图所示。
①其中符合0.1 mol·L-1 NH4Al(SO4)2溶液的pH随温度变化的曲线是________(填字母),导致pH随温度变化的原因是 ;
 ②20 ℃时,0.1 mol·L-1 NH4Al(SO4)2溶液中2c(SO
②20 ℃时,0.1 mol·L-1 NH4Al(SO4)2溶液中2c(SO )-c(NH
)-c(NH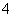 )-3c(Al3+)=________。
)-3c(Al3+)=________。
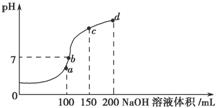
(4)室温时,向100 mL 0.1 mol·L-1 NH4HSO4溶液中滴加0.1 mol·L-1 NaOH溶液,溶液pH与NaOH溶液体积的关系曲线如图所示.试分析图中a、b、c、d四个点,水的电离程度最大的是________点,在b点,溶液中各离子浓度由大到小的排列顺序是 。
 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:
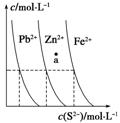 如图为某温度下,PbS(s)、ZnS(s)、FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液的S2-浓度、金属阳离子浓度变化情况。下列说法正确的是( )
如图为某温度下,PbS(s)、ZnS(s)、FeS(s)分别在溶液中达到沉淀溶解平衡后,溶液的S2-浓度、金属阳离子浓度变化情况。下列说法正确的是( )
A.三种难溶物的溶度积Ksp(FeS)的最小
B.如果向三种沉淀中加盐酸,最先溶解的是PbS
C.向新生成的ZnS浊液中滴入足量含相同浓度的Pb2+、Fe2+的溶液,振荡后,ZnS沉淀会转化为PbS沉淀
D.对于三种难溶物来讲,a点对应的都是不饱和溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA表示阿伏加德罗常数,下列叙述中正确的是( )
A.常温常压下,11.2 L CO2所含的原子数为1.5NA
B.常温常压下,48 g O3含有的氧原子数为3NA
C.标准状况下,22.4 L H2O所含分子数为NA
D.标准状况下,22.4 L H2中所含原子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验方案不能成功的是( )
A通过测浓度均为0.01 mol·L-1的溶液的pH大小来鉴别盐酸和乙酸
B向均含石蕊的盐酸和乙酸溶液中分别加入NaCl、CH3COONa来鉴别盐酸和乙酸是否为弱电解质
C加热蒸发FeCl3溶液制备FeCl3晶体
D测浓度均为0.1 mol·L-1的NaCl、CH3COONa溶液的pH来鉴别盐酸和乙酸是否为弱电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
某化学小组在实验室中利用CaSO4、NH3、CO2制备(NH4)2SO4,工艺流程如下。
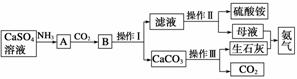
回答下列问题:
(1)操作Ⅰ的名称________,操作Ⅱ需要用到的仪器有铁架台(带铁圈)、酒精灯、玻璃棒和________。
(2)所得母液显酸性的原因用离子方程式表示为______________。检验该溶液含有铵根离子的方法是____________________________。
(3)下列装置能用于实验室制氨气的是________(填序号)。
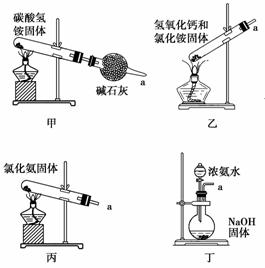
选择氨气的制取装置后,再选用下列装置收集干燥的氨气,并制取硫酸铵溶液,连接的顺序(用接口序号字母表示)是:a接__________________________。
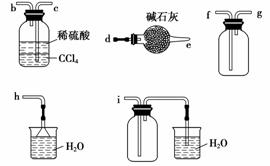
(4)该小组还通过实验研究氨气的性质。
利用下图所示装置探究NH3能否被NO2氧化(K1、K2为止水夹,夹持固定装置略去)。
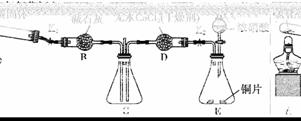
E装置中制取NO2反应的离子方程式是____________。A中发生反应的化学方程式为__________________。
若NH3能被NO2氧化全部生成无毒物质,预期观察到C装置中的现象是____________。若此反应转移电子0.4 mol,则消耗标准状况下的NO2________ L。
实验过程中,未能观察到C装置中的预期现象。该小组同学从反应原理的角度分析了原因,认为可能是:
①NO2氧化性较弱,不能将NH3氧化;
②在此条件下,NH3的转化率极低;
③________________________________________________________________________。
此实验装置存在一个明显的缺陷是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
有难溶于水的粉末状固体样品,可能含Al、Fe2O3、Cu2O、SiO2、Fe3O4中的一种或几种。研究小组通过实验确定样品的成分。
查阅资料知:
①Cu2O+2H+===Cu+Cu2++H2O;
②部分氢氧化物在溶液中沉淀的pH见下表:
| 物质 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 1.8 | 6.3 | 5.2 |
| 完全沉淀的pH | 3.0 | 8.3 | 6.7 |
注:金属离子的起始浓度为0.1 mol·L-1
实验步骤:
Ⅰ.取一定量样品于烧杯中,加足量NaOH溶液,有气体产生,过滤得固体A和无色溶液B;
Ⅱ.向B中加入稀硫酸,出现白色沉淀,继续滴加稀硫酸至过量,白色沉淀完全溶解;
Ⅲ.向A中加入足量稀硫酸并微热,固体完全溶解,得溶液C;
Ⅳ.向C中加入NaClO,调节溶液的pH至4~5,产生红褐色沉淀,过滤得到蓝绿色溶液D;
Ⅴ.向D中加入NaOH,调节溶液的pH到7~8,产生蓝色絮状沉淀。
请回答下列问题。
(1)Ⅰ中产生气体的离子方程式为__________________。
(2)由Ⅰ、Ⅱ知,原样品中一定不存在的物质是________。
(3)溶液C中除H+、Cu2+外一定还含有的阳离子是__________;为验证溶液C中存在该阳离子,可选用的试剂及对应的现象是__________________。
(4)Ⅳ中加NaClO的目的是______________。
(5)由上述实验可以获得结论:原样品所有可能的成分组合为____________;________________。(用化学式表示、任写两种即可)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列曲线图(纵坐标为沉淀的物质的量,横坐标为加入物的体积)不正确的是
( )
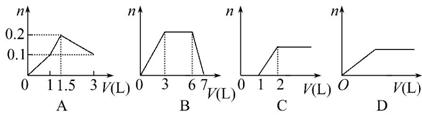
A.向1 L浓度均为0.1 mol·L-1的Ba(OH)2、NaAlO2混合液加入0.1 mol·L-1
稀硫酸
B.向1 L含有0.1 mol·L-1AlCl3和0.3 mol·L-1NH4Cl的混合液中加入0.1 mol·L-1
NaOH溶液
C.向烧碱溶液滴加明矾溶液
D.向AlCl3溶液滴加过量氨水
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验设计能够达到目的的是( )
| 编号 | 实验目的 | 实验设计 |
| A | 证明盐酸酸性比醋酸强 | 用同一电路测等体积盐酸、醋酸溶液的导电性 |
| B | 证明H2CO3酸性比H2SiO3强 | 将CO2通入Na2SiO3溶液中 |
| C | 证明钠的金属活动性比铜强 | 向CuCl2溶液中投入金属钠 |
| D | 证明溶液中含有I- | 向溶液中加入淀粉溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com