
| A、CuCl2 (CuO) |
| B、NaOH (NaOH) |
| C、CuSO4 (CuCO3) |
| D、NaCl (NaOH) |
| ||
| ||


科目:高中化学 来源: 题型:

| A、试管b中导气管下端管口不能浸入液面的目的是防止实验过程中产生倒吸现象 |
| B、实验时加热试管a的目的之一是及时将乙酸乙酯蒸出,使平衡向生成乙酸乙酯的方向移动 |
| C、试管b中饱和Na2CO3溶液的作用是吸收随乙酸乙酯蒸出的少量乙酸和乙醇 |
| D、向a试管中先加入浓硫酸,然后边摇动试管边慢慢加入乙醇,再加冰醋酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1000 ml |
| B、500 ml |
| C、100 ml |
| D、1500 ml |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯碱工业中,氢氧化钠在电解槽的阴极区产生 |
| B、氯气和氢气混合在光照条件下生成氯化氢,用水吸收得到盐酸 |
| C、二氧化硫在接触室被氧化成三氧化硫,三氧化硫在吸收塔内被水吸收制成浓硫酸 |
| D、合成氨工业中,利用氨易液化,分离出N2、H2循环使用,总体上提高了氨的产率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原混合溶液中c(K+)=1 mol/L |
| B、上述电解过程中一共转移电子0.8 mol |
| C、电解得到的铜的物质的量为0.2 mol |
| D、电解后溶液中c(H+)=2 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
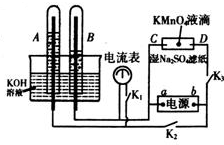 在如图所示装置中,试管A、B中的电极为多孔的惰性电极;C、D为两个铂夹夹在被Na2SO4溶液浸湿的滤纸条上.滤纸条的中部滴有KMnO4液滴;电源有a、b两极.在A、B 中充满KOH溶液后倒立于KOH溶液的水槽中,切断K1,闭合K2、K3,通直流电.
在如图所示装置中,试管A、B中的电极为多孔的惰性电极;C、D为两个铂夹夹在被Na2SO4溶液浸湿的滤纸条上.滤纸条的中部滴有KMnO4液滴;电源有a、b两极.在A、B 中充满KOH溶液后倒立于KOH溶液的水槽中,切断K1,闭合K2、K3,通直流电.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分离四氯化碳和水的混合物用分液漏斗 |
| B、用100 mL的量筒量取5.2 mL的盐酸 |
| C、用托盘天平称取25.20g NaCl |
| D、用100 mL容量瓶配制50 mL 0.1 mol/L的盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| t/min | COmol/L) | H2O(mol/L) | CO2(mol/L) | H2(mol/L) |
| 0 | 0.2 | 0.3 | 0 | 0 |
| 2 | n1 | n2 | n3 | 0.1 |
| 3 | n1 | n2 | n3 | 0.1 |
| 4 | 0.09 | 0.19 | 0.11 | 0.11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com