
| 温度/℃ | 0 | 10 | 20 | 40 | 60 | 80 |
| KIO3g/100g水 | 4.60 | 6.27 | 8.08 | 12.6 | 18.3 | 24.8 |
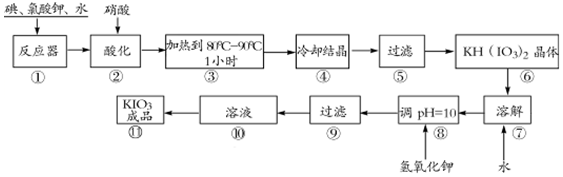
分析 工业生产碘酸钾的流程:用碘和氯酸钾溶液反应生成碘酸氢钾、氯化钾和氯气,再加入硝酸,加热促使氯气从反应体系中逸出,经冷却结晶,过滤得碘酸氢钾晶体,将碘酸氢钾晶体溶于水,加入氢氧化钾溶液,使碘酸氢钾生成碘酸钾,过滤后得碘酸钾溶液,将滤液进行蒸发浓缩、冷却结晶、过滤洗涤,可得碘酸钾晶体,
(1)反应中I2→KH(IO3)2,I元素化合价由0价升高为+5价,共升高10价,KClO3→KCl、Cl2,氯元素化合价降低,还原产物为KCl、Cl2,KClO3→KCl氯元素化合价由+5降低为-1价,化合价降低6价,KClO3→Cl2氯元素化合价由+5降低为0价,化合价总共降低10价,二者获得的电子数目相同,获得电子最小公倍数为30,则KCl的系数为5,Cl2的系数为3,所以化合价降低60价,故I2系数为6,根据元素守恒配平KClO3、H2O、KH(IO3)2的系数;
(2)酸化的目的是将氯气从反应混合物中逸出;
(3)由题中信息可知,在碱性条件下碘酸钾能被氯气氧化为高碘酸钾;
(4)由表中数据可知温度越高,KIO3溶解度越大,从溶液中获得晶体需要蒸发结晶,冷却结晶.
解答 解:(1)反应中I2→KH(IO3)2,I元素化合价由0价升高为+5价,共升高10价.KClO3→KCl、Cl2,氯元素化合价降低,还原产物为KCl、Cl2,KClO3→KCl氯元素化合价由+5降低为-1价,化合价降低6价,KClO3→Cl2氯元素化合价由+5降低为0价,化合价总共降低10价,二者获得的电子数目相同,获得电子最小公倍数为30,则KCl的系数为5,Cl2的系数为3,所以化合价降低共60价,故I2系数为6,根据氯元素守恒可知KClO3系数为11,根据碘元素守恒可知KH(IO3)2的系数为6,根据氢元素守恒可知H2O、系数为3,检查氧元素守恒,故方程式为:6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑;
故答案为:6I2+11KClO3+3H2O=6KH(IO3)2+5KCl+3Cl2↑;
(2)酸化的目的是将氯气从反应混合物中逸出;
故答案为:促进氯气从反应混合物中逸出;
(3)由题中信息可知,在碱性条件下碘酸钾能被氯气氧化为高碘酸钾,所以应将氯气排出;
故答案为:Cl2能将KIO3氧化成KIO4;
(4)由表中数据可知温度越高,KIO3溶解度越大,从溶液中获得KIO3晶体需要蒸发结晶,冷却结晶;
故答案为:蒸发浓缩、冷却结晶.
点评 本题考查氧化还原反应、阅读题目获取信息、对工艺流程的理解等,难度中等,需要学生具备根据信息进行分析问题、解决问题的能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 向FeCl2溶液中通入Cl2:Fe2++Cl2═Fe3++2Cl- | |
| B. | Ba(OH)2溶液与硫酸反应:OH-+H+═H2O | |
| C. | 次氯酸钙溶液中通入少量SO2:2ClO-+Ca2++SO2+H2O═CaSO3↓+2HClO | |
| D. | 碳酸氢钠溶液中加入过量石灰水:HCO3-+Ca2++OH-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 苯、油脂均不能使酸性KMnO4溶液褪色 | |
| B. | 甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应 | |
| C. | 葡萄糖、果糖的分子式均为C6H12O6,二者互为同分异构体 | |
| D. | 除去乙酸乙酯中的乙酸,先加入饱和Na2CO3溶液再分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下pH=13的溶液中能大量存在:Na+、Al3+、Cl-、SO42- | |
| B. | 与金属铝反应有大量气泡产生的无色溶液中:Fe2+、Mg2+、NO3-、Cl- | |
| C. | 含有大量Fe3+的溶液中:SCN-、I-、Na+、Cl- | |
| D. | 溶液通入足量氨气后各离子还能大量存在:K+、Na+、SO42-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na与稀硫酸反应的离子方程式为2Na+2H+═2 Na++H2↑ | |
| B. | Na2O2溶于水产生O2:2Na2O2+2H2O=4Na++4OH-+O2↑ | |
| C. | 碳酸氢钙溶液中滴加氢氧化钠溶液至Ca2+恰好完全沉淀 Ca2++HCO3-+OH-=CaCO3↓+H2O | |
| D. | 饱和碳酸钠溶液中通入过量二氧化碳气体,溶液变浑浊CO32-+CO2+H2O=HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com