
铜是一种重要的金属元素,位于元素周期表第ⅠB族,+1价的铜与氯离子结合的生成的CuCl是一种难溶物质,但它可与过量的Cl-形成可溶于水的络离子[CuCl2]-。含铜最丰富的天然资源是黄铜矿(CuFeS2)。
(1)目前有一种湿法冶炼技术,以黄铜矿为主要原料来生产铜、铁红颜料和可用于橡胶硫化的硫单质,原料的综合利用率较高。其主要流程如下:
①请完成反应Ⅰ中FeCl3与CuFeS2反应的化学方程式:
CuFeS2 + FeCl3 = +4 + 2S。
②写出反应Ⅳ中发生反应的离子方程式:
。
③反应Ⅲ是FeCO3在空气中煅烧,其化学方程式是
。
④已知Cu+在反应V中发生自身氧化还原反应,歧化为Cu2+和Cu。则反应Ⅴ所得溶液A中含有的溶质有 。
(2)传统工艺从黄铜矿冶炼粗铜的技术,是将精选后的富铜矿砂与空气在高温下煅烧,使其转变为铜。与上面湿法冶炼技术方法比较,新方法的优点是 、 。
((16分)
(1)(共12分)
① 3 CuCl FeCl2(3分)
② Cl-+ CuCl = [CuCl2]-(2分)
③ 4FeCO3 + O2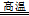 4CO2 + 2Fe2O3(3分)
4CO2 + 2Fe2O3(3分)
④ CuCl2、 NaCl (4分)
(2)(共4分)不会产生SO2污染大气(2分),不用煅烧黄铜矿从而节约热能 [或可得副产品铁红和硫,合理答案都行。2分]
解析试题分析:(1)①读图可知,缺少的生成物为FeCl2、CuCl,硫元素由—2升为0,设CuFeS2的系数为1,则2个硫原子升高总数为4,铜元素由+2降为+1,1个铜原子降低数为1,由于升降总数相等,则铁元素由+3降为+2,需要3个铁原子降低总数3,则CuFeS2+3FeCl3=CuCl+4FeCl2+2S;②依题意,难溶的CuCl与可溶的NaCl在水中发生反应,其原理为Cl-+ CuCl = [CuCl2]-;③依题意,该反应的反应物是FeCO3和O2,生成物是Fe2O3和CO2,铁元素由+2升为+3价,氧元素由0降为—2价,根据最小公倍数法配平可得:4FeCO3 + O2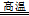 4CO2 + 2Fe2O3;依题意,Na[CuCl2]在水中发生反应V,铜元素由+1部分升高为+2,部分降低为0,则溶液A中含有Cl-、Cu2+和Na+,所以推断A的溶质主要是CuCl2和NaCl;(2)传统方法需要高温煅烧,不仅消耗大量的能量,而且还产生大量的SO2等有毒气体,污染空气,新方法的优点是不会产生SO2污染大气,不用煅烧黄铜矿从而节约热能,可得副产品铁红和硫。
4CO2 + 2Fe2O3;依题意,Na[CuCl2]在水中发生反应V,铜元素由+1部分升高为+2,部分降低为0,则溶液A中含有Cl-、Cu2+和Na+,所以推断A的溶质主要是CuCl2和NaCl;(2)传统方法需要高温煅烧,不仅消耗大量的能量,而且还产生大量的SO2等有毒气体,污染空气,新方法的优点是不会产生SO2污染大气,不用煅烧黄铜矿从而节约热能,可得副产品铁红和硫。
考点:考查有关物质制备的化学工艺流程推断题,涉及化学方程式的配平、主要流程中离子方程式、推断溶液的主要溶质、评价两种工艺的优缺点等。


科目:高中化学 来源: 题型:单选题
在实验室利用浓盐酸和MnO2制氯气,制备装置中应安装分液漏斗而不能使用长颈漏斗,有关理由叙述错误的是
| A.防止氯气扩散到空气中造成污染 | B.便于控制加入盐酸的量 |
| C.长颈漏斗不便于添加液体 | D.尽量避免HCl挥发到空气中 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。ClO2是一种黄绿色的气体,易溶于水。实验室以NH4Cl、盐酸、NaClO2(亚氯酸钠)为原料制备ClO2的流程如下:
(1)除去ClO2中的NH3可选用的试剂是 ;可用于制取NH3的是________(填序号)
| A.饱和食盐水 | B.碱石灰 | C.浓硫酸 | D.水 E.NH4HCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
软锰矿中含MnO2约70%,SiO2约20%,Al2O3约4%,其余为水分;闪锌矿中含ZnS约80%,FeS、CuS、SiO2共约7%,其余为水分。科研人员开发了综合利用这两种资源的同槽酸浸工艺,制取Zn、MnO2和Na2SO4。其工艺流程如下:
(1)I的滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2(SO4)3等。写出MnO2、CuS与硫酸反应的化学方程式: ;
(2)已知Fe(OH)3、Al(OH)3、Zn(OH)2三种物质开始沉淀和完全沉淀时溶液的pH如下表:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Zn(OH)2 |
| 开始沉淀pH | 2.3 | 4.0 | 5.6 |
| 完全沉淀pH | 4.1 | 5.2 | 8.0 |

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
用如图所示装置可以收集以下几种气体(烧瓶位置不动)(填字母,下同);
①H2 ②SO2 ③CH4④ HCl ⑤ NH3 ⑥ NO ⑦H2S
(1)若烧瓶是干燥的,则由A口进气,可收集到的气体有 ,由B口进气,可收集的气体有 。
(2)若在烧瓶中充满水,可收集的气体有 ,气体由 口进入。
(3)若此装置用于净化气体,在烧瓶内装有洗涤液,则混合气体应由 口进入。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
溴化锂常用于制冷工业,可用尿素、碳酸锂及溴为原料生产溴化锂,其原理是
3Br2+3Li2CO3+CO(NH2)2 6LiBr+2H2O+N2↑+4CO2↑其主要工艺流程如下:
6LiBr+2H2O+N2↑+4CO2↑其主要工艺流程如下:
(1)溴化时,pH过小对反应不利,一方面是因为碳酸锂会反应生成_____________,另一方面使溴单质和水的反应平衡向_______移动,温度不宜超过60℃的原因是_______。
(2)反应过程中,若pH>6,产品中会有溴酸盐,其原因是BrO-发生了自身的氧化还原反应,写出反应的离子方程式:________________。
(3)试剂X的化学式为_____________,加活性炭处理的目的是________________。
(4)若直接用氨水代替尿素也可生产溴化锂,同时生成水、二氧化碳和氮气,该反应的化学方程式为_________________。
(5)用惰性电极电解熔融碳酸锂可得到金属锂,则阳极的电极方程式为______________。
(6)若原料中碳酸锂的质量为mg,最终得到溴化锂的质量为ng,据此能不能计算出溴化锂的产率?若能请写出其表达式(含m、n的表达式);若不能,请说明理由______________。
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
实验室制取的乙烯常含有少量二氧化硫,现设计如下实验,确认混合气体中有乙烯和二氧化硫。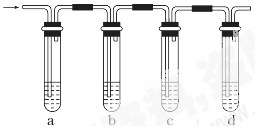
(1)a、b、c、d装置可盛放的试剂是:a________,b______,c_____,d______。
| A.品红溶液 | B.NaOH溶液 | C.浓硫酸 | D.酸性高锰酸钾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
实验桌上只有烧碱、盐酸、铜片、大理石、蒸馏水五种试剂,从欠缺试剂的角度来看(实验仪器齐全),无法进行的实验项目是
| A.制取氢气 | B.制取碳酸钠 |
| C.制取氯化铜 | D.测定盐酸的浓度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com