
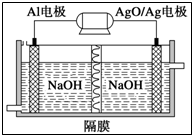
 (1)现有以下物质:
(1)现有以下物质:

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、溴苯中混有溴,有汽油箤取出溴 |
| B、硝基苯中混有浓HNO3和浓H2SO4,将其倒入到NaOH溶液中,静置,分液 |
| C、乙烷中混有乙烯,通氢气在一定条件下反应,使乙烯转化为乙烷 |
| D、乙烯中混有SO2和CO2,将其先后通入NaOH和KMnO4溶液洗气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
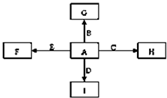 图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的
图中,A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的| 高温 |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
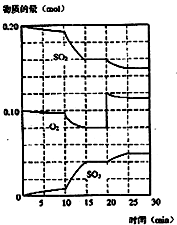 (1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示
(1)化学平衡常数K表示可逆反应的进行程度,K值越大,表示| 体系 | c(SO2) mol/L | c(O2) mol/L | c(SO3) mol/L | 反应方向 |
| (1) | 0.0600 | 0.400 | 2.000 | |
| (2) | 0.0960 | 0.300 | 0.500 |
查看答案和解析>>
科目:高中化学 来源: 题型:
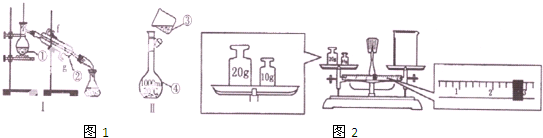
查看答案和解析>>
科目:高中化学 来源: 题型:
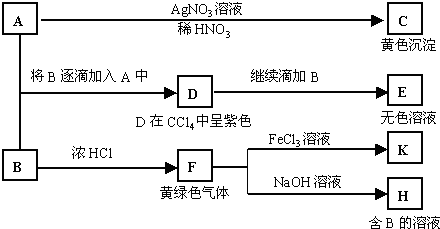
查看答案和解析>>
科目:高中化学 来源: 题型:
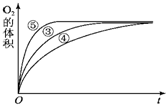 某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如下方案完成实验.| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL 2% H2O2溶液 | 无 |
| ② | 10mL 5% H2O2溶液 | 无 |
| ③ | 10mL 5% H2O2溶液 | 1mL 0.1mol?L-1 FeCl3溶液 |
| ④ | 10mL 5% H2O2溶液+少量HCl溶液 | 1mL 0.1mol?L-1 FeCl3溶液 |
| ⑤ | 10mL 5% H2O2溶液+少量NaOH溶液 | 1mL 0.1mol?L-1 FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
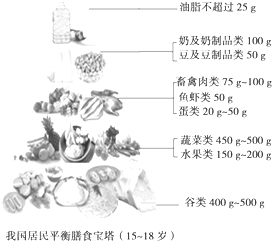 《2011中国居民膳食指南》,该书由一般人群膳食指南、特定人群膳食指南和平衡膳食宝塔三部分组成.仔细研究中国居民平衡膳食宝塔,回答以下问题.
《2011中国居民膳食指南》,该书由一般人群膳食指南、特定人群膳食指南和平衡膳食宝塔三部分组成.仔细研究中国居民平衡膳食宝塔,回答以下问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com