
| ||
| ||
| ||
| ||
| 1.31g |
| 2.00g |


 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案科目:高中化学 来源: 题型:
48 22 |
| A、大于 | B、小于 |
| C、等于 | D、不能肯定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
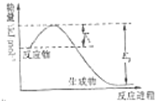 氮是地球上含量丰富的一种元素,氮及其化合物在生产生活中有着重要作用.请回答下列问题:
氮是地球上含量丰富的一种元素,氮及其化合物在生产生活中有着重要作用.请回答下列问题:| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
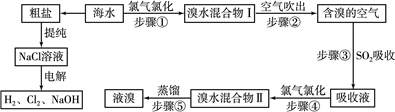
查看答案和解析>>
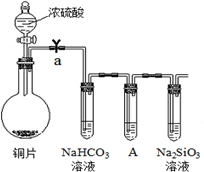
科目:高中化学 来源: 题型:
 下表是元素周期表的一部分,表中所列字母分别代表一种元素.
下表是元素周期表的一部分,表中所列字母分别代表一种元素.| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 一 | A | ||||||
| 二 | B | C | D | E | |||
| 三 | F | G | H | I | K | ||
| 四 | J | L |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com