
【题目】一定量的锌与过量的稀H2SO4反应制取氢气,一定温度下为减慢反应速率而又不影响产生氢气的量,可向其中加入( )
A.CH3COOK固体B.CuCl2固体C.KNO3溶液D.铁粉
 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】在容积固定的VL密闭容器中充入4molNH3和5molO2,发生如下反应:4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g)。请回答下列问题:
4NO(g)+6H2O(g)。请回答下列问题:
(1)下列能说明该反应已经达到平衡状态的是_______;
A 容器中气体总质量不变
B c(O2)不变
C v(O2)=1.25v(NH3)
D 体系压强不变
E 相同时间内,消耗0.1 mol NH3,同时消耗了0.1 mol NO
(2)若反应在绝热密闭系统中进行时,其余条件不变,反应速率是先增大后减小。则速率逐渐增大是因为______,速率又逐渐减小的原因是_____。
(3)1mol NH3(g)在纯氧中完全燃烧生成无污染的气态物质,放出akJ的热量。写出该反应的热化学方程式__________________________________________。
(4)若将(3)所述反应设计为电解质溶液为KOH的原电池,则负极反应式 _________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.离子化合物中可能含有共价键
B.分子晶体中的分子内不含有共价键
C.分子晶体中一定有非极性共价键
D.分子晶体中分子一定紧密堆积
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)1 mol石墨转变成金刚石需要吸收1.9 kJ的热量该反应的热化学方程式是__________。
(2)在25℃、101kPa下,一定质量的无水乙醇完全燃烧时放出热量QkJ,其燃烧生成的CO2用过量饱和石灰水吸收可得100gCaCO3沉淀,则乙醇燃烧的热化学方程式为_________。
(3)已知下列热化学方程式
Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g) ΔH1=-25 kJ·mol-1 ①
3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g) ΔH2=-47 kJ·mol-1 ②
Fe3O4(s)+CO(g)===3FeO(s)+CO2(g) ΔH3=+19 kJ·mol-1 ③
写出FeO(s)被CO还原成Fe和CO2的热化学方程式_________________。
(4)向足量H2SO4溶液中加入100 mL 0.4 mol·L-1Ba(OH)2溶液,放出的热量是5.12 kJ。如果向足量Ba(OH)2溶液中加入100 mL 0.4 mol·L-1盐酸时,放出的热量为2.2 kJ。则Na2SO4溶液与BaCl2溶液反应的热化学方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳的化合物在生产、生活中有着重要的作用。
(1)已知:2CO(g)+O2(g) ![]() 2CO2(g) △H1=-566kJ·molˉ1
2CO2(g) △H1=-566kJ·molˉ1
H2O(g)+CO(g) ![]() H2(g)+CO2(g) △H2=-41kJ·molˉ1
H2(g)+CO2(g) △H2=-41kJ·molˉ1
CO(g)+2H2(g) ![]() CH3 OH(g) △H3=-107 kJ. molˉ1
CH3 OH(g) △H3=-107 kJ. molˉ1
则CH3OH(g)+![]() O2(g)
O2(g) ![]() CO2(g)+2H2O(g) △H=___________kJ·molˉ1,增大压强,CH3OH(g)的转化率___________(填“增大”“减小”或“不变”,下同),升高温度,CH3OH(g)的转化率___________。
CO2(g)+2H2O(g) △H=___________kJ·molˉ1,增大压强,CH3OH(g)的转化率___________(填“增大”“减小”或“不变”,下同),升高温度,CH3OH(g)的转化率___________。
(2)T℃时,向容积均为2L的A、B两个密闭容器中均通入4.0 mol CO2和6.8molH2,发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H=—50kJ·molˉ1。A容器中的反应在恒温、恒容条件下进行;B容器中的反应在恒温、恒压条件下进行,测得A容器中CO2的转化率[α(CO2)]随时间的变化如图所示。
CH3OH(g)+H2O(g) △H=—50kJ·molˉ1。A容器中的反应在恒温、恒容条件下进行;B容器中的反应在恒温、恒压条件下进行,测得A容器中CO2的转化率[α(CO2)]随时间的变化如图所示。

①在0~5min内A容器中v(CH3OH)=_______;该温度下上述反应的平衡常数K=_______(保留两位有效数字)。
②反应开始至平衡的过程中,A、B两容器中CO2的消耗速率的大小关系为v(A) ________(填“>”“<”或“=”)v(B)。
③下列各项指标能表明A容器中反应的v正>v逆的是___(填标号)
a.体系内的压强增大
b.气体的平均相对分子质量增大
c.断裂H-H键的数目是形成C-O键数目的2倍
d.v逆(CO2)=v正(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以硫铁矿(FeS2的质量分数为60%)为原料制备氯化铁晶体(FeCl3·6H2O,270.5g·moˉ1)的工艺流程如图所示。
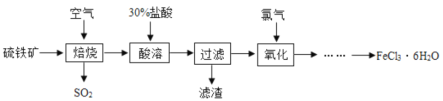
请回答下列问题:
(1)为加快焙烧反应的化学反应速率,可采取的措施为_____、_____。(任写两条)
(2)焙烧后得到的Fe2O3在酸溶过程中发生反应的离子方程式为________。
(3)过滤操作用到的玻璃仪器有烧杯、_______、______。
(4)焙烧过程中产生的SO2可用过量的氨水进行吸收,所得溶液中溶质的名称为_______。
(5)先向氯化铁溶液中加适量盐酸的目的是______,再______、______、过滤、洗涤,最终得到氯化铁晶体。
(6)若取1kg硫铁矿经过上述流程(铁元素在整个流程中损失率为4%),则可得氯化铁晶体的质量为_______(保留一位小数)kg。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家成功实现甲烷在催化剂及无氧条件下,一步高效生产乙烯、芳烃和氢气等化学品,为天然气化工开发了一条革命性技术。以甲烷为原料合成部分化工产品流程如下(部分反应条件已略去):
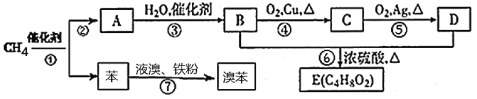
(1)E 的名称为____,B物质的结构简式:______;
(2)上述③~⑥转化反应中,属于取代反应的有______(用反应序号填写);
(3)写出反应⑦的反应方程式:______;
(4)如图为实验室制取E的装置图,图中a试剂为_______;
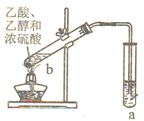
(5)某同学在试管b中加入6.0克乙酸和足量乙醇采用适当条件使反应充分进行,结束后在试管b回收到3.0克乙酸,则该同学在本次实验中制得乙酸乙酯的最大质量为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某学生的化学实验报告中有如下记录其中实验数据合理的( )
A.用100 mL量筒量取5.26 mL稀硫酸溶液
B.用托盘天平称取11.7 g CuO粉末
C.用广泛pH试纸测得溶液的pH为3.5
D.温度计上显示的室温读数为25.68 ℃
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com