
| A. | 将80gNaOH溶于1L水中,所得溶液中NaOH的物质的量浓度为2mol•L-1 | |
| B. | 18gH2O在标准状况下的体积是22.4L | |
| C. | 22.4LO2中一定含有6.02×1023个氧分子 | |
| D. | 在标准状况时,20mLNH3与60mLNO所含的原子个数比为2:3 |
分析 A、依据n=$\frac{m}{M}$计算物质的量,溶液体积大于1L;
B、标准状态下,水不是气体,是液体;
C、22.4LO2的物质的量和温度压强有关系,根据V=nVm来计算即可;
D、根据n=$\frac{V}{Vm}$可结合分子的组成分析计算即可.
解答 解:A、80g NaOH固体计算氢氧化钠物质的量,n=$\frac{m}{M}$=2mol,溶液体积大于1L,80g NaOH固体溶于1L水中,所得NaOH溶液的物质的量浓度小于2mol•L-1,故A错误;
B、标准状态下,水不是气体,是液体,18gH2O在标准状况下的物质的量不是1mol,体积不是22.4L,故B错误;
C、只有标准状况下,22.4L即1molO2中含有6.02×1023个氧分子,故C错误;
D、由n=$\frac{V}{Vm}$可知,两种气体的物质的量分别为$\frac{0.02L}{22.4L/mol}$、$\frac{0.06L}{22.4L/mol}$,则原子的物质的量之比为($\frac{0.02L}{22.4L/mol}$×4):($\frac{0.06L}{22.4L/mol}$×2)=2:3,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的分析应用,主要是气体摩尔体积条件分析应用,学会质量、物质的量、微粒数之间的计算,掌握基础是关键,题目较简单.


 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案科目:高中化学 来源: 题型:选择题
| A. | 溶液中C(OH-)=0.1mol•L-1 | B. | 溶液中C(OH-)>C(H+) | ||
| C. | 该氨水的浓度为0.1mol•L-1 | D. | 溶液中水的离子积为1×10-14 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加水稀释后,溶液中c(H+)减小 | |
| B. | 加入少量NaOH固体,电离度增大,溶液的pH增大 | |
| C. | 加入少量NH4Cl固体,氨水电离平衡向右移动 | |
| D. | 通入少量HCl气体后,电离平衡常数不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B | C | D | |
| A | - | - | ↑ | |
| B | - | ↓ | ↓ | |
| C | - | ↓ | - | |
| D | ↑ | ↓ | - |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3与H+反应生成的NH4为正四面体结构 | |
| B. | NH3分子内3个共价键的键角、键长相等 | |
| C. | NH3分子内3个共价键的键长相等,3个键角都等于107° | |
| D. | NH3分子内3个共价键的键长相等,3个键角都等于120° |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 目的 | A.实验室制取并收集O2 | B.检验装置气密性 | C.制取蒸馏水 | D.分离水和四氯化碳 |
| 装置或操作 |  |  | 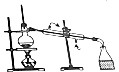 | 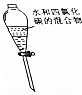 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
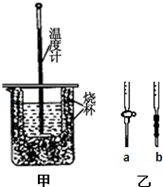 酸碱中和反应是中学化学一类重要的反应,某学生实验小组对课本中的两个酸碱中和实验进行了研究.
酸碱中和反应是中学化学一类重要的反应,某学生实验小组对课本中的两个酸碱中和实验进行了研究.| 实验次数 | 起始滴定管读数 | 终点滴定管读数 |
| 1 | 0.00mL | 24.02mL |
| 2 | 0.50mL | 24.46mL |
| 3 | 2.50mL | 25.02mL |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
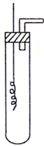 某学习小组为证明并观察铜与稀HNO3反应的产物是NO,设计了如下图所示的实验装置.请你根据他们的思路,选择下列药品完成实验,填写实验步骤并回答问题.供选择的药品:铜丝、稀硝酸、烧碱溶液、铁粉、CaCO3颗粒.
某学习小组为证明并观察铜与稀HNO3反应的产物是NO,设计了如下图所示的实验装置.请你根据他们的思路,选择下列药品完成实验,填写实验步骤并回答问题.供选择的药品:铜丝、稀硝酸、烧碱溶液、铁粉、CaCO3颗粒.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com