
科目:高中化学 来源:不详 题型:填空题
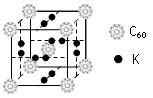
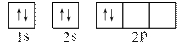

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
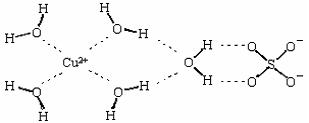
| A.水 | B.四氯化碳 | C.苯 | D.硫酸镍溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
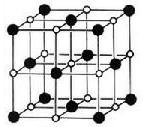
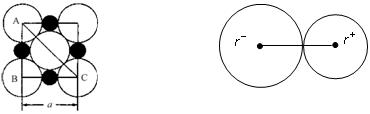
 =_______________。
=_______________。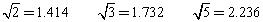 )
)查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.晶体中分子间作用力越大,分子越稳定 |
| B.分子中共价键越强,该物质熔点越高 |
| C.铁熔化时金属键被破坏 |
| D.氯化钠溶于水时离子键未被破坏 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原子晶体中可能存在极性共价键 | B.干冰升华时分子内共价键发生断裂 |
| C.原子晶体的熔点比分子晶体的熔点高 | D.离子晶体中只含离子键,不含共价键 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.碘和氯化钾 | B.金刚石和重晶石 |
| C.二氧化硅和干冰 | D.软脂酸甘油酯和冰醋酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.同一主族的元素与另一相同元素所形成的化学式相似的物质不一定具有相同的晶体结构 |
| B.一个CO2晶体的最小重复结构单元中含有6个CO2分子 |
| C.二氧化碳晶体是分子晶体,其中不仅存在分子间作用力,而且也存在共价键 |
| D.在二氧化硅晶体中,平均每个Si原子形成4个Si—O共价单键 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NH4NO3、NaOH中既有离子键,又有极性共价键,其中NH4NO3中还有配位键 |
| B.水的沸点是100℃,硫化氢的分子结构跟水相似,但它的沸点却很低,是-60.7℃,引起这种差异的主要原因是水分子间有氢键 |
| C.范德华力与氢键可同时存在于分子之间 |
| D.氢键比范德华力强,且氢键是一种特殊的化学键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com