
【题目】某校科学兴趣小组探究二氧化碳与过氧化钠反应是否有氧气生成,设计了如图的实验,装置B中盛有饱和碳酸氢钠溶液,目的是除去二氧化碳中混有的氯化氢气体,E为收集氧气装置。
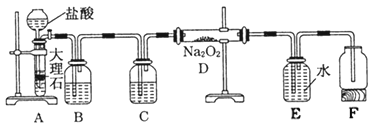
(1)C中盛有________,目的是________。
(2)写出装置D中发生反应的化学方程式___________。
(3)指出装置E的错误___________________。
【答案】浓硫酸 吸收CO2中的水分(干燥气体),防止水蒸气与Na2O2反应产生O2对反应干扰 2Na2O2 + 2CO2 = 2Na2CO3 + O2 集气瓶中导管应该左短右长
【解析】
A装置中大理石与盐酸反应制取CO2;B装置中饱和碳酸氢钠溶液用于除去二氧化碳中混有的HCl气体;由于过氧化钠与水蒸气反应生成氧气,所以通入D装置中的CO2必须是干燥的,则C中盛放浓硫酸,用于干燥CO2;装置D中实现过氧化钠与二氧化碳的反应;E为排水法收集氧气;据此分析作答。
(1)A装置中由大理石与盐酸反应制得的二氧化碳中混有HCl和H2O(g),B装置中盛放饱和碳酸氢钠溶液,用于除去二氧化碳中混有的HCl,水蒸气也能与过氧化钠反应生成O2,为防止水蒸气与Na2O2反应产生的O2对反应的干扰,C装置中盛放浓硫酸,用于干燥二氧化碳;故答案为:浓硫酸 吸收CO2中的水分(干燥气体),防止水蒸气与Na2O2反应产生O2对反应干扰;
(2)装置D中过氧化钠与二氧化碳反应生成碳酸钠和氧气,反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2;故答案为:2Na2O2+2CO2=2Na2CO3+O2;
(3)根据装置图,E装置采用排水法收集氧气,为了将E装置中的水排入F中,E装置中集气瓶的导管应左短右长;故答案为:集气瓶中导管应该左短右长。


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
【题目】实验室从废定影液[含Ag(S2O3)23-和Br-等]中回收Ag和Br2的主要步骤为:向废定影液中加入Na2S溶液沉淀银离子,过滤、洗涤、干燥,灼烧Ag2S制取金属Ag;制取C12并将Cl2通入滤液中氧化Br-,再用苯萃取分液。其中部分实验操作的装置如下图所示:
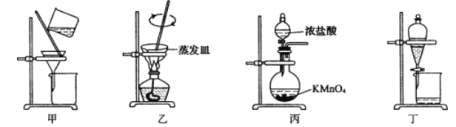
下列叙述正确的是
A. 用装置甲分离Ag2S时,用玻璃棒不断搅拌
B. 用装置乙在通风橱中高温灼烧Ag2S制取Ag
C. 用装置丙制备用于氧化过滤液中Br-的Cl2
D. 用装置丁分液时,先放出水层再换个烧杯继续放出有机层
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 若反应X + Y = M是放热反应,该反应一定不用加热。
B. 需要加热方能发生的反应一定是吸热反应。
C. 1mol硫酸与足量氢氧化钠发生中和反应生成水所释放的热量称为中和热。
D. CO2与CaO化合是放热反应,则CaCO3分解是吸热反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)、 一定条件下,将SO2和O2充入一密闭容器中,发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g)(正反应放热)反应过程中SO2、O2、SO3物质的量变化如图所示:回答下列问题:
2SO3(g)(正反应放热)反应过程中SO2、O2、SO3物质的量变化如图所示:回答下列问题:

(1)降低温度,SO2的转化率_________,化学反应速度_________。(填“增大”“减小”或“不变”)
(2)反应处于平衡状态的时间是_________。
(3)反应进行至20 min时,曲线发生变化的原因是______________________(用文字表达)。10 min到15 min的曲线变化的原因可能是_________(填写编号)。
a. 加了催化剂 b. 缩小容器体积
c. 降低温度 d. 增加SO3的物质的量
(二) 在一个固定体积的密闭容器中,充入 2 mol A 和1 mol B,发生如下反应:2 A(g) + B(g)![]() 3C(g) + D(s), 反应达到平衡时 C的浓度为1.2 mol/L。
3C(g) + D(s), 反应达到平衡时 C的浓度为1.2 mol/L。
(1)若使容器温度升高,平衡时混合气体的平均相对摩尔质量减小,则正反应为_____反应(填“吸热”或“放热”)反应。
(2)若维持容器体积和温度不变,按下列方法加入起始物质,达到平衡时C的浓度仍为1.2 mol/L的是____________(用序号填空)
① 4 mol A + 2 mol B ② 3 mol C + 1 mol D + 1 mol B
③ 3 mol C + 2 mol D ④ 1.6 mol A + 0.8 mol B + 0.6 mol C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用原电池原理,在室温下从含低浓度铜的酸性废水中回收铜的实验装置如图所示,下列说法错误的是
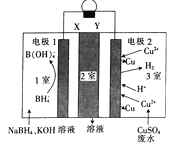
A. X、Y依次为阳离子、阴离子选择性交换膜
B. 负极的电极反应式:BH4-+8OH-一8e-═B(OH)4-+4H2O
C. 2室流出的溶液中溶质为Na2SO4和K2SO4
D. 电路中每转移1mol电子,电极2上有32gCu析出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于配制980mL,0.1mol·![]() 的
的![]() 溶液的实验,下列说法正确的是
溶液的实验,下列说法正确的是
A. 需要称取![]() 固体的质量为16.0g
固体的质量为16.0g
B. 一定用到的玻璃仪器有 1000 mL 的容量瓶、烧杯、玻璃棒、漏斗、胶头滴管
C. 为加快![]() 固体的溶解,可适当加热,然后趁热将溶液转移到容量瓶中
固体的溶解,可适当加热,然后趁热将溶液转移到容量瓶中
D. 倒转摇匀后发现液面低于刻度线,若补加蒸馏水至刻度线会使所得溶液的浓度偏低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了除去KCl溶液中少量的MgCl2、MgSO4,可选用Ba(OH)2溶液、盐酸和K2CO3溶液。三种试剂,按下图步骤操作,下列说法错误的是( )
![]()
A.A物质是Ba(OH)2 溶液,为了除尽Mg2+和SO42-
B.B物质是碳酸钠溶液,为了除尽过量的Ba2+
C.C物质是稀盐酸 ,除去过量的CO32-
D.为了除去过量的稀盐酸,加热煮沸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家研发出一种新型水溶液锂电池,采用复合膜包裹的金属锂作负极,锰酸锂(LiMn2O4)作正极,以0.5mol/L Li2SO4水溶液作电解质溶液。电池充、放电时,LiMn2O4与Li2Mn2O4可以相互转化。下列有关该电池的说法正确的是( )
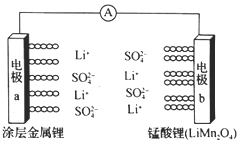
A.该电池放电时,溶液中的SO42-向电极b移动
B.该电池负极的电极反应式为:2Li+2H2O=2LiOH+H2↑
C.电池充电时,阳极的电极反应式为:Li2Mn2O4-e-=LiMn2O4+Li+
D.电池充电时,外加直流电源的正极与电极a相连
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)Na2Sx在碱性溶液中可被NaClO氧化为Na2SO4,而NaClO被还原为NaCl,若反应Na2Sx与 NaClO的物质的量之比为1∶16,则x的值为_________。
(2)实验室制取氯气,将多余的氯气用100 mL 1.7mol/LNaOH溶液完全吸收。对吸收后溶液进行分析化验,测知c(OH-)=0.1mol/L (不考虑反应前后溶液的体积变化),ClO-和ClO3-的物质的量浓度之比为5∶1。请回答:
①被还原的氯气的物质的量为 _______________mol。
②若采用二氧化锰和浓盐酸共热的方法制氯气,制备尾气中的氯气所消耗的二氧化锰的质量为_______________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com