
分析 (1)依据热化学方程式和盖斯定律计算,由盖斯定律②-2×①得到所需热化学方程式;
(2)先将MgCl2•6H20转化为MgCl2•NH4Cl•nNH3,然后在700℃脱氨得到无水氯化镁,依据原子守恒书写化学方程式;
(3)氯酸根离子具有氧化性,可以将亚铁离子氧化为正三价;根据化学反应得出各物质之间的关系式,计算百分含量;
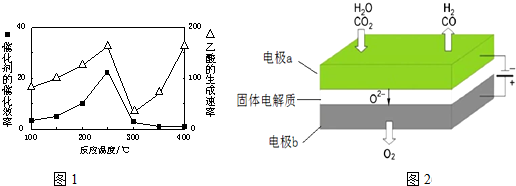
(4)根据温度对催化剂活性的影响;
(5)①二氧化碳为酸性气体,Li2O、Na2O、MgO均能吸收CO2与氧化性无关;
②根据题干信息,反应物为CO2与Li4SiO4,生成物有Li2CO3,根据质量守恒进行解答;
(6)二氧化碳、水分别在a极得到电子发生还原反应生成一氧化碳、氢气,同时生成氧离子.
解答 解:(1)①Mg(s)+H2(g)═MgH2(s)△H1=-74.5kJ•mol-1
②Mg2Ni(s)+2H2(g)═Mg2NiH4(s)△H2=64.4kJ•mol-1
Mg2Ni(s)+2MgH2(s)═2Mg(s)+Mg2NiH4(s)△H3
由盖斯定律②-2×①得到Mg2Ni(s)+2MgH2(s)═2Mg(s)+Mg2NiH4(s)△H3 =64.4KJ/mol-2×(-74.5KJ/mol)=213.4KJ/mol,则△H3=213.4KJ/mol,
故答案为:213.4;
(2)MgCl2•NH4Cl•nNH3,在700℃脱氨得到无水氯化镁,反应的化学方程式MgCl2•NH4Cl•nNH3$\frac{\underline{\;700℃\;}}{\;}$MgCl2+(n+1)NH3↑+HCl↑;
故答案为:MgCl2•NH4Cl•nNH3$\frac{\underline{\;700℃\;}}{\;}$MgCl2+(n+1)NH3↑+HCl↑;
(3)氯酸根离子具有氧化性,可以将亚铁离子氧化为正三价,化学方程式为:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O,根据化学方程式:ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O以及Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O,可以得出:ClO3-~6Fe2+,Cr2O72-~6Fe2+,用0.100mol•L-1 K2Cr2O7溶液滴定至终点过程可以得出剩余的亚铁离子的物质的量为:0.100mol•L-1×0.015L×6=0.009mol,和氯酸根离子反应的亚铁离子的物质的量为:20×10-3L×1.000mol•L-1-0.009mol=0.011mol,
氯酸根离子的物质的量为:$\frac{1}{6}$×0.011mol,产品中Mg(ClO3)2•6H2O的质量分数:($\frac{1}{12}$×0.011×299g/mol)×10×$\frac{1}{3.5}$×100%=78.3%,
故答案为:78.3%;
(4)温度超过250℃时,催化剂的催化效率降低,所以温度升高而乙酸的生成速率降低,
故答案:温度超过250℃时,催化剂的催化效率降低;
(5)①a.Li2O、Na2O、MgO均属于碱性氧化物,均能吸收酸性氧化物CO2,可在碱性氧化物中寻找吸收CO2的其他物质,故a正确;
b.Li2O、Na2O、MgO均能吸收CO2,钠、镁、铝为ⅠA、ⅡA族元素,所以可在ⅠA、ⅡA族元素形成的氧化物中寻找吸收CO2的其他物质,故b正确;
c.Li2O、Na2O、MgO均能吸收CO2,但它们都没有强氧化性,且吸收二氧化碳与氧化还原无关,故c错误;
故答案为:ab;
②在500℃,CO2与Li4SiO4接触后生成Li2CO3,反应物为CO2与Li4SiO4,生成物有Li2CO3,根据质量守恒可知产物还有Li2SiO3,所以化学方程式为:CO2+Li4SiO4$\frac{\underline{\;500℃\;}}{700℃}$Li2CO3+Li2SiO3,
故答案为:CO2+Li4SiO4$\frac{\underline{\;500℃\;}}{700℃}$Li2CO3+Li2SiO3;
(6)二氧化碳在a极得到电子发生还原反应生成一氧化碳同时生成氧离子,反应电极反应式为:CO2+2e-═CO+O2-,故答案为:CO2+2e-═CO+O2-.
点评 本题考查对常见金属元素及其化合物主要性质的掌握,主要是氧化还原反应,电子转移计算,滴定实验步骤和含量的计算分析,有机物结构和反应过程分析是解题关键,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
 已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气.
已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气.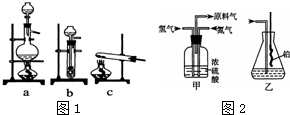
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
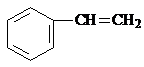 B的分子式为C4H8O3
B的分子式为C4H8O3| 甲 | 乙 (五元环状化合物) | 丙 (经缩聚反应生成) | 丁 (经加聚反应生成) |
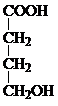 |  | 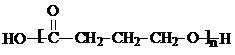 |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有② | B. | ①和③ | C. | ②和③ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同周期主族元素的原子半径以ⅦA族的为最大 | |
| B. | 在周期表中零族元素的单质常温常压下全部是气体 | |
| C. | ⅠA、ⅡA族元素的原子,其半径越大就越容易得电子 | |
| D. | 非金属元素的最低负价都和它的族序数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
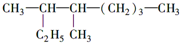 的名称是3,4一二甲基辛烷,
的名称是3,4一二甲基辛烷, ,1mol该烃完全燃烧需消耗氧气18.5mol,
,1mol该烃完全燃烧需消耗氧气18.5mol,查看答案和解析>>
科目:高中化学 来源: 题型:填空题
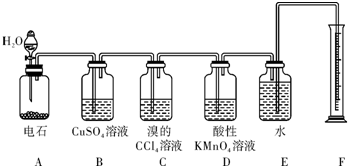
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com