
| A. | 还原剂是HCl,氧化剂是KMnO4 | |
| B. | 每生成1mol Cl2转移电子的物质的量为2mol | |
| C. | 氧化剂与还原剂的物质的量之比为1:8 | |
| D. | 氧化产物与还原产物的物质的量之比为5:2 |
分析 2KMnO4+16HCl=2MnCl2+2KCl+5Cl2↑+8H2O反应中Mn元素化合价降低,被还原,Cl元素化合价升高,被氧化,以此解答该题.
解答 解:2KMnO4+16HCl=2MnCl2+2KCl+5Cl2↑+8H2O反应中Mn元素化合价降低,被还原,Cl元素化合价升高,被氧化,
A.Cl元素化合价升高,被氧化,则还原剂是HCl,Mn元素化合价降低,被还原,则氧化剂是KMnO4,故A正确;
B.Cl元素化合价从-1价升高到0价,则每生成1mol Cl2转移电子的物质的量为2mol,故B正确;
C.反应中16molHCl中只有10个作还原剂,则氧化剂与还原剂的物质的量之比为2:10=1:5,故C错误;
D.反应中MnCl2为还原产物,Cl2为氧化产物,则氧化产物与还原产物的物质的量之比为5:2,故D正确.
故选C.
点评 本题考查氧化还原反应,为高频考点,侧重于学生的分析能力的考查,注意从元素化合价的角度认识相关概念以及物质具有的性质,难度不大.


 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:选择题
| A. | 在中毒过程中血红蛋白被氧化 | B. | 解毒时血红蛋白被还原 | ||
| C. | 维生素C应具有还原性 | D. | 中毒时亚硝酸盐发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2+、Cl-、K+、SO42- | B. | CO32-、Na+、K+、SO42- | ||
| C. | Mg2+、Cl-、K+、NO3- | D. | Ag+、NO3-、K+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
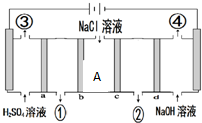
| A. | a和c为阳离子交换膜,b和d为阴离子交换膜 | |
| B. | ③与④两种气体体积比为1:1 | |
| C. | ①处生成的物质为氢氧化钠 | |
| D. | 当转移2mol e-时,A处减少离子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知:①N2(g)+O2(g)=2NO(g)△H1=+180kJ•mol-1
已知:①N2(g)+O2(g)=2NO(g)△H1=+180kJ•mol-1| A. | 反应②中的能量变化如右图所示,则△H2=E1-E3 | |
| B. | H2的燃烧热为241.8 kJ•mol-1 | |
| C. | 由反应②知在温度一定的条件下,在一恒容密闭容器中通入1 mol N2和3 mol H2,反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则184.8>Q2>2Q1 | |
| D. | 氨的催化氧化反应为4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=+906 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对阳极区溶液呈蓝色的正确解释是:2I--2e-=I2,碘遇淀粉变蓝 | |
| B. | 对阳极区溶液呈蓝色的正确解释是:Cu-2e-=Cu2+,Cu2+显蓝色 | |
| C. | 阴极区溶液呈红色的原因是:2H++2e-=H2↑,使阴极附近OH- 浓度增大,溶液显碱性,从而使酚酞变红 | |
| D. | 阴极上的电极反应式为:Cu2++2e-=Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与水反应:Na+2H2O═Na++OH-+H2↑ | |
| B. | 铁与硫酸铜溶液反应:Fe+Cu2+═Fe2++Cu | |
| C. | 碳酸钙与盐酸反应:CO32-+2H+═CO2↑+H2O | |
| D. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-═BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 28g乙烯所含共用电子对数目为4NA | |
| B. | 1 mol甲基(-CH3)所含的电子总数为9NA | |
| C. | 0.5 mol1,3-丁二烯分子中含有C=C双键数为NA | |
| D. | 标准状况下,11.2 L己烷所含分子数为0.5 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
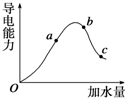 在25℃时,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,请回答:
在25℃时,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,请回答:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com