
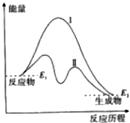
| A. | 曲线Ⅰ和曲线Ⅱ分别表示两个化学反应的能量变化 | |
| B. | 曲线Ⅱ可表示反应2NH3$?_{高温高压}^{催化剂}$N2+3H2的能量变化 | |
| C. | 该反应不需要加热就能发生 | |
| D. | 该反应的△H=E2-E1 |
分析 A、曲线Ⅰ和曲线Ⅱ都是指同一反应物生成同一生成物;
B、曲线Ⅱ反应物能量大于生成物能量,则该反应为放热反应;
C、反应放热与反应条件没有必然的联系;
D、依据反应物和生成物能量变化判断反应吸热、放热.
解答 解:A、曲线Ⅰ和曲线Ⅱ都是指同一反应物生成同一生成物,所以表示一个化学反应的能量变化,故A错误;
B、曲线Ⅱ反应物能量大于生成物能量,则该反应为放热反应,又2NH3$?_{高温高压}^{催化剂}$N2+3H2为吸热反应,所以不可表示反应2NH3$?_{高温高压}^{催化剂}$N2+3H2的能量变化;故B错误;
C、图中分析判断反应是放热反应,△H<0,但反应放热与反应条件没有必然的联系,有许多放热在开始时要加热的,故C错误;
D、依据图象分析判断,该反应为放热反应,△H=E2-E1,故D正确;
故选D.
点评 本题考查了反应焓变的计算判断,图象分析是关键,反应自发进行的判断依据,催化剂的作用分析是解题关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | Ca2+、Na+、NO${\;}_{3}^{-}$、CO${\;}_{3}^{2-}$ | B. | Na+、Cl-、NH${\;}_{4}^{+}$、SO${\;}_{4}^{2-}$ | ||
| C. | K+、Cl-、HCO${\;}_{3}^{-}$、H+ | D. | Ca2+、Na+、Fe3+、NO${\;}_{3}^{-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3COO-的水解方程式:CH3COO-+H2O?CH3COOH+OH- | |
| B. | HCO3-的水解方程式:HCO3-+H2O?CO32-+H3O+ | |
| C. | CO32-的水解方程式:CO32-+2H2O?H2CO3+2OH- | |
| D. | Fe3+的水解方程式:Fe3++3OH-?Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 工业上主要采用氨氧化法生产硝酸,如图是氨氧化率与氨-空气混合气中氧氨比的关系.其中直线表示反应的理论值;曲线表示生产实际情况.当氨氧化率达到100%,理论上r$\frac{n({O}_{2})}{n(N{H}_{3})}$=1.25,实际生产要将r值维持在1.7~2.2之间,原因是O2太少不利于NH3的转化,r值为2.2时NH3氧化率已近100%.
工业上主要采用氨氧化法生产硝酸,如图是氨氧化率与氨-空气混合气中氧氨比的关系.其中直线表示反应的理论值;曲线表示生产实际情况.当氨氧化率达到100%,理论上r$\frac{n({O}_{2})}{n(N{H}_{3})}$=1.25,实际生产要将r值维持在1.7~2.2之间,原因是O2太少不利于NH3的转化,r值为2.2时NH3氧化率已近100%.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{n}{2.4R}$ mol•L-1 | B. | $\frac{1000nρ}{17n+22.4m}$mol•L-1 | ||
| C. | $\frac{n}{22.4}$mol•L-1 | D. | $\frac{1000ρ}{17n+22.4m}$mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com