
(物质结构与性质)有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子后3p轨道全满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等于中子数.R是由A、D两元素形成的离子化合物,其中A与D离子数之比为2∶1.请回答下列问题:
(1)A单质、B单质、化合物R的熔点大小顺序为下列的________(填序号):
①A单质>B单质>R;
②R>A单质>B单质;
③B单质>R>A单质;
④A单质>R>B单质.
(2)在CB3分子中C元素原子的原子轨道发生的是________杂化,其固体时的晶体类型为________.
(3)写出D原子的核外电子排布式________,C的氢化物比D的氢化物在水中溶解度大得多的可能原因________.
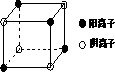
(4)下图是D和Fe形成的晶体FeD2最小单元“晶胞”,FeD2晶体中阴、阳离子数之比为________,FeD2物质中具有的化学键类型为________.
科目:高中化学 来源: 题型:
 (2011?金台区模拟)(物质结构与性质)有A?B?C?D?E?F六种元素,除E为第4周期元素外其余均为短周期元素,且A?B?C?F?D?E原子序数依次增大.A?E位于元素周期表的s区,其余元素位于p区,A?E的原子外围电子层排布相同,A的原子中没有成对电子;B元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子总数相同;C元素原子的外围电子层排布式为nsnnpn+1;D元素的一种单质易自燃;F的基态原子核外成对电子数是成单电子数的3倍?回答下列问题:
(2011?金台区模拟)(物质结构与性质)有A?B?C?D?E?F六种元素,除E为第4周期元素外其余均为短周期元素,且A?B?C?F?D?E原子序数依次增大.A?E位于元素周期表的s区,其余元素位于p区,A?E的原子外围电子层排布相同,A的原子中没有成对电子;B元素基态原子中电子占据三种能量不同的原子轨道且每种轨道中的电子总数相同;C元素原子的外围电子层排布式为nsnnpn+1;D元素的一种单质易自燃;F的基态原子核外成对电子数是成单电子数的3倍?回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:



查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 【选修3:物质结构与性质】
【选修3:物质结构与性质】查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com