
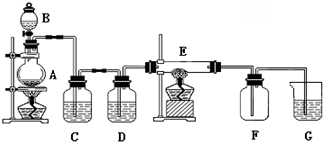
| ||
| ||
| ||


 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
| A、氯气和水反应:Cl2+H2O═2H++Cl-+ClO- | ||
| B、用醋酸除去水垢:CaCO3+2CH3COOH═Ca2++2CH3COO--+H2O+CO2↑ | ||
| C、将丙烯通入溴水中:CH3-CH═CH2+Br2→CH3CHBrCH2Br | ||
D、甲烷与氧气反应:CH4+2O2
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、N2、O2和NO的物质的量浓度相等 |
| B、反应体系中的压强不随时间变化 |
| C、N2、O2、NO三种物质同时存在 |
| D、单位时间内生成1mol N2 同时消耗1mol O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
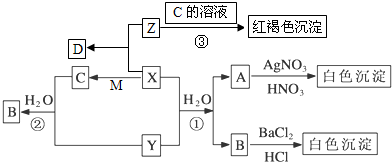
查看答案和解析>>
科目:高中化学 来源: 题型:
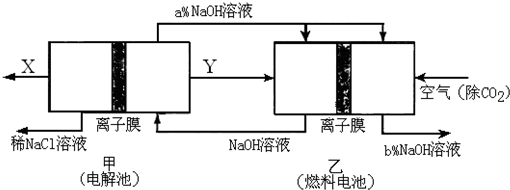
| 溶质 | Na2CO3 | NaClO | NaHCO3 | NaHSO3 |
| pH | 11.6 | 10.3 | 9.7 | 5.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
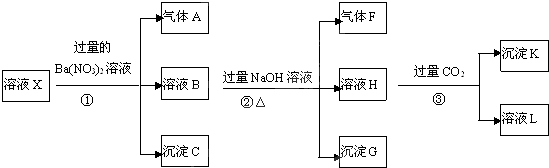
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
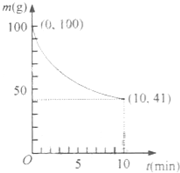 镍具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料.羰基法提纯粗镍涉及的两步反应依次为:
镍具有优良的物理和化学特性,是许多领域尤其是高技术产业的重要原料.羰基法提纯粗镍涉及的两步反应依次为:| 50℃ |
| 230℃ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com