
下列实验操作或对实验事实的叙述中,正确的是( )
A. 用氨气做喷泉实验主要是利用氨气的水溶液呈碱性这一性质
B. 向浓硫酸中缓慢加蒸馏水,以稀释浓硫酸
C. 常温下,浓硝酸可贮存于铁制或铝制容器中
D. 向溶液中加入硝酸酸化的BaCl2溶液,产生白色沉淀,说明一定含有SO42﹣
考点: 化学实验方案的评价.
专题: 实验评价题.
分析: A.氨气易溶于水而形成喷泉;
B.加入试剂顺序错误;
C.常温下,浓硝酸与铁、铝发生钝化反应;
D.可能生成AgCl沉淀.
解答: 解:A.氨气易溶于水而形成喷泉,如溶液的酸碱性无关,主要是利用可形成压强差的原理,故A错误;
B.浓硫酸具有腐蚀性,溶于水放热,稀释浓硫酸时,应将浓硫酸沿烧杯内壁缓缓注入水中,并用玻璃棒不断搅拌,故B错误;
C.常温下,浓硝酸与铁、铝发生钝化反应,则浓硝酸可贮存于铁制或铝制容器中,故C正确;
D.应先加入盐酸,如无现象,再加入氯化钡检验,故D错误.
故选C.
点评: 本题考查较为综合,涉及物质的性质实验,侧重于学生的分析能力、实验能力和评价能力的考查,为高考常见题型和高频考点,注意把握物质的性质的异同以及实验的严密性的评价,难度中等.


科目:高中化学 来源: 题型:
下列说法正确的是()
A. 我国自主研发的“龙芯1号”CPU芯片与光导纤维是同种材料
B. 需要通过化学反应才能从海水中获得食盐和淡水
C. 水晶项链和餐桌上的瓷盘都是硅酸盐制品
D. 粗硅制备单晶硅涉及氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
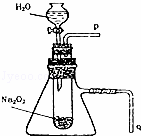
用脱脂棉花包住约0.2g过氧化钠粉末,置于石棉网上,往脱脂棉上滴水,可观察到脱脂棉剧烈燃烧起来.
(1)由实验现象所得出的有关Na2O2和H2O反应的结论是 (填序号)
a.反应放热 b.棉花在空气中可以自燃
c.有O2生成 d.Na2O2在空气中可以自燃
(2)写出Na2O2和H2O反应的化学方程式 .
(3)某校研究性学习小组拟用如图装置进行实验,以证明上述结论.为验证得到的气体产物所进行实验操作方法及现象是: .
查看答案和解析>>
科目:高中化学 来源: 题型:
将Fe片和Al片放在盛有NaCl溶液(其中滴入酚酞)的表面皿中,如图表示,最先观察到变红色的区域为()
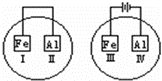
A. II和Ⅳ B. Ⅱ和Ⅲ C. Ⅰ和Ⅲ D. Ⅰ和Ⅳ
查看答案和解析>>
科目:高中化学 来源: 题型:
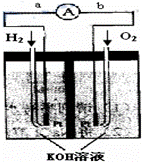
氢氧燃料电池是符合绿色化学理念的新型发电装置.下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
(1)氢氧燃料电池的能量转化主要形式是 ,在导线中电子流动方向为 (用a、b 表示).
(2)负极反应式为 .
(3)电极表面镀铂粉的原因为增
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能.因此,大量安全储氢是关键技术之一.金属锂是一种重要的储氢材料,吸氢和放氢原理如下:Ⅰ.2Li+H2 2LiHⅡ.LiH+H2O═LiOH+H2↑
2LiHⅡ.LiH+H2O═LiOH+H2↑
①反应Ⅰ中的还原剂是Li,反应Ⅱ中的氧化剂是H2O.
②用锂吸收224L(标准状况)H2,再由生成的LiH与H2O作用放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为 .
③若改用熔融碳酸盐为电解质,CH4为燃料,空气为氧化剂,稀土金属材料做电极.已知负极的电极反应是CH4+4CO32﹣﹣8e﹣=5CO2+2H2O.则正极的电极反应是 .为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,此电池工作时必须有部分A物质参加循环,则A物质的化学式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组性质比较中,正确的是( )
①酸性:HClO4>HBrO4>HIO4
②离子还原性:S2﹣>Cl﹣>Br﹣>I﹣
③沸点:HF>HCl>HBr>HI
④金属性:K>Na>Mg>Al
⑤气态氢化物稳定性:HF>HCl>H2S
⑥半径:O2﹣>Na+>Na>Cl.
A. ①②③ B. ②③④ C. ①④⑤ D. ①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”、“纸漏斗的下部被烧穿,有熔融物落入沙中”.查阅《化学手册》知,Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
物质 Al Al2O3 Fe Fe2O3
熔点/℃ 660 2054 1535 1462
沸点/℃ 2467 2980 2750 ﹣﹣
I.该同学推测,铝热反应所得到的熔融物应是铁铝合金.理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金.请你设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝.该实验所用试剂是 ,反应的离子方程式为 .
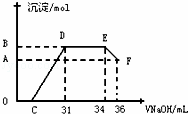
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入4mol•L﹣1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:
(1)图中OC段没有沉淀生成,此阶段发生反应的离子为: .
(2)在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方为 .
(3)当c=13mL时,原溶液中Fe3+与Al3+的物质的量之比为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com