
| A. | 原混合物中铜元素的质量不一定为0.64g | |
| B. | 生成气体体积为2.016L | |
| C. | 实验中反应的硫酸的物质的量为0.1mol | |
| D. | 原混合物中铁的质量分数为87.5% |
分析 生成可燃性气体,说明铁粉过量,发生反应:Fe+H2SO4=FeSO4+H2↑,反应后的溶液为浅绿色,且只有一种金属离子,则发生反应CuO+H2SO4=CuSO4+H2O后,又发生CuSO4+Fe=FeSO4+Cu,且Cu被完全置换;根据Cu的质量计算CuO质量,进而计算Fe的质量,根据电子转移计算生成氢气的质量.
解答 解:生成可燃性气体,说明发生反应Fe+H2SO4=FeSO4+H2↑,溶液为浅绿色,只有一种金属离子,则发生CuO+H2SO4=CuSO4+H2O后,又发生CuSO4+Fe=FeSO4+Cu,且Cu被完全置换,
生成0.64gCu,其物质的量:$\frac{0.64}{g64g/mol}$=0.01mol,由Cu元素守恒可知n(CuO)=n(Cu)=0.01mol,
故混合物中:m(CuO)=0.01mol×80g/mol=0.8g,则:m(Fe)=6.40g-0.8g=5.6g,n(Fe)=$\frac{5.6g}{56g/mol}$=0.1mol,
A.根据分析可知,铜的质量为0.64g,故A错误;
B.设氢气的物质的量为nmol,根据电子转移守恒可得:2n+0.01mol×2=0.1mol×2,解得n=0.09mol,没有告诉在标准状况下,不能使用标准状况下气体摩尔体积计算氢气体积,故B错误;
C.铁的物质的量为0.1mol,反应生成溶质为硫酸亚铁,则反应消耗的硫酸的物质的量为0.1mol,故C正确;
D.由上述分析可知,Fe的质量为5.6g,混合物中Fe的质量分数为:$\frac{5.6g}{6.4g}$×100%=87.5%,故D正确;
故选CD.
点评 本题考查了混合物反应的计算,题目难度中等,明确发生反应的原理为解答关键,注意掌握守恒思想在化学计算中的应用,试题培养了学生的化学计算能力.


科目:高中化学 来源: 题型:选择题
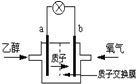 2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200°C左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全.电池总反应为:C2H5OH+3O2═2CO2+3H2O,电池示意如图,下列说法不正确的是( )
2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200°C左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全.电池总反应为:C2H5OH+3O2═2CO2+3H2O,电池示意如图,下列说法不正确的是( )| A. | 电池工作时,1mol乙醇被氧化时就有6mol电子转移 | |
| B. | a极为电池的负极 | |
| C. | 电池工作时电流由b极沿导线经灯泡再到a极 | |
| D. | 电池正极的电极反应为:4H++O2+4e-═2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
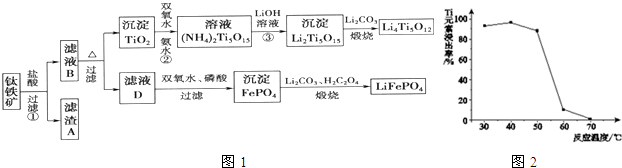
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入氯化钡溶液有白色沉淀生成,再加稀硝酸,沉淀不消失,则原溶液中一定有SO42- | |
| B. | 加入烧碱溶液后加热,产生能使湿润的红色石蕊试纸变蓝的气体,则原溶液中一定有NH4+ | |
| C. | 加入盐酸,放出能使澄清的石灰水变浑浊的无色的气体,则原溶液中一定含有CO32- | |
| D. | 加入AgNO3溶液,有白色沉淀生成,在原溶液中一定含有Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com