
分析 根据n=$\frac{m}{M}$计算氢气、硫酸、乙醇的物质的量,根据n=$\frac{N}{{N}_{A}}$计算HCl的物质的量,根据m=ρV计算水的质量,再根据n=$\frac{m}{M}$计算水的物质的量.
根据V=nVm可知,气体的物质的量越大,体积越大,硫酸、乙醇与水是液体,相同物质的量的体积远远小于气体的体积;
根据N=nNA可知,物质的量越大,含有分子数目越多;
由各物质的量的分子式可知,氢气中氢原子物质的量是氢气的2倍,二氧化碳中原子的物质的量是二氧化碳的3倍,HCl中原子的物质的量等于HCl的2倍,硫酸中原子的物质的量硫酸分子的7倍,乙醇中原子物质的量为乙醇的9倍,水中原子的物质的量是水的3倍,据此计算判断;
根据m=nM计算二氧化碳、氯化氢的质量,根据m=ρV计算水的质量,据此判断.
解答 解:A、6g H2的物质的量为$\frac{6g}{2g/mol}$=3mol,
B、0.5mol CO2,
C、HCl的物质的量为$\frac{1.204×1{0}^{24}}{6.02×1{0}^{23}}$=2mol,
D、147g H2SO4的物质的量为$\frac{147g}{98g/mol}$=1.5mol,
E、92g乙醇的物质的量=$\frac{92g}{46g/mol}$=2mol,
F、水的质量为18mL×1g/mL=18g,水的物质的量为$\frac{18g}{18g/mol}$=1mol;
物质的量最大的是6g氢气;硫酸、乙醇与水是液体,相同物质的量体积远远小于气体,根据V=nVm可知,气体的物质的量越大,体积越大,故体积最大的是6gH2;
氢气中含有原子为3mol×2=6mol,二氧化碳中含有原子为0.5mol×3=1.5mol,HCl中含有原子为2mol×2=4mol,硫酸中含有原子为1.5mol×7=10.5mol,乙醇中含有原子物质的量=2mol×9=18mol,水中含有原子为1mol×3=3mol,故含有原子最多的是:92g 乙醇;
氢气的质量6g,CO2的质量为0.5mol×44g/mol=22g,HCl的质量为2mol×34g/mol=68g,硫酸的质量147g,乙醇的质量为92g,水的质量为18mL×1g/mL=18g,故质量最大的是:147g 硫酸,
故答案为:A;A;E;D.
点评 本题考查常用化学计量的有关计算,比较基础,注意对公式的理解与运用,注意基础知识的理解掌握.


科目:高中化学 来源: 题型:选择题
| A. | SiO2是酸性氧化物,它对应的水化物是硅酸(H2SiO3) | |
| B. | 硅酸可由SiO2跟水反应制得 | |
| C. | SiO2可与碱性氧化物或强碱反应 | |
| D. | 光导纤维的主要原料就是SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
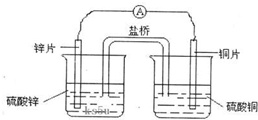
| A. | 盐桥中的阴离子向硫酸铜溶液中迁移 | |
| B. | 电子从锌电极通过检流计流向铜电极 | |
| C. | 锌电极发生还原反应,铜电极发生氧化反应 | |
| D. | 铜电极上发生的电极反应是2H++e-→H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Na+2H2O═2NaOH+H2 | B. | 2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑ | ||
| C. | 2Na2O2+2H2O═4NaOH+O2↑ | D. | CuO+H2$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质的量就是物质的数量或质量 | |
| B. | 1 mol氯约含有6.02×1023个微粒 | |
| C. | 水的摩尔质量是它的相对分子质量 | |
| D. | 1 mol CO2含有1 mol碳原子和2 mol氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
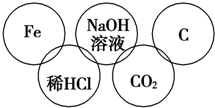 小美在五连环中填入了5种物质,相连环物质间能发生反应,不相连环物质间不能发生反应.请完成下列问题:
小美在五连环中填入了5种物质,相连环物质间能发生反应,不相连环物质间不能发生反应.请完成下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| Fe3+ | Fe2+ | Cu2+ | |
| 氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
| 氢氧化物完全沉淀时的pH | 4 | 9.0 | 6.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com