【答案】
分析:X、Y、Z和W为原子序数依次增大的短周期元素,X是空气中含量最高的元素,故X为氮元素;Y 和Z同主族,Z和W的气态氢化物具有相同的电子数,Y的单质只有氧化性,故Y为氧元素,Z为硫元素.W为氯元素.
(1)硫化氢分子中氢原子与硫原子之间形成1对共用电子对;Ar原子核外有18个电子,有3个电子层,最外层电子数为8;
(2)阳离子Cu
2+放电,阴离子为水电离的OH
-放电生成氧气;
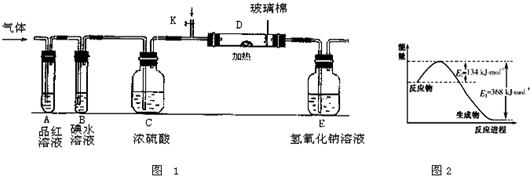
(3)①二氧化硫与品红化合物无色物质,氯气与水反应生成次氯酸,次氯酸具有强氧化性,将品红氧化为无色物质;
②令碘元素在氧化产物中的化合价为a,则根据电子转移守恒有5.0×10
-3L×1.0×10
-3mol/L×2×a=5.0×10
-5mol,解得a=+5,所以碘单质被氧化为HIO
3,据此书写方程式;
(4)当加入氨水时,使该溶液变为碱性,产生BaSO
3白色沉淀(或当加入HNO
3时,使溶液中H
2SO
3氧化成H
2SO
4,产生BaSO
4白色沉淀);
(5)由图2可知1molNO
2和1molCO反应生成CO
2和NO放出能量234kJ,据此书写热化学反应方程式;
(6)结构铵根离子的水解书写.
解答:解:X、Y、Z和W为原子序数依次增大的短周期元素,X是空气中含量最高的元素,故X为氮元素;Y 和Z同主族,Z和W的气态氢化物具有相同的电子数,Y的单质只有氧化性,故Y为氧元素,Z为硫元素.W为氯元素.
(1)Z为硫元素,Z的气态氢化物为硫化氢,分子中氢原子与硫原子之间形成1对共用电子对,结构式为H-S-H;W为氯元素
,与W同周期惰性气体元素是Ar,Ar原子核外有18个电子,有3个电子层,最外层电子数为8,Ar原子结构示意图为

,故答案为:H-S-H;

;
(2)用惰性电极电解Cu(NO
3)
2溶液,阳离子Cu
2+放电,阴离子水电离的OH
-放电生成氧气,离子反应方程式为2Cu
2++2H
2O

2Cu+4H
++O
2↑,故答案为:2Cu
2++2H
2O

2Cu+4H
++O
2↑;
(3)①二氧化硫与氯气都可以是品红溶液褪色,在装置A中观察到的现象是相同,故答案为:相同;
②若装置B中装有5.0mL 1.0×10
-3mol/L的碘水,当通入足量Cl
2完全反应后,转移的电子为5.0×10
-5mol,令碘元素在氧化产物中的化合价为a,则根据电子转移守恒有5.0×10
-3L×1.0×10
-3mol/L×2×a=5.0×10
-5mol,解得a=+5,所以碘单质被氧化为HIO
3,则该反应的化学方程式为5Cl
2+I
2+6H
2O=2HIO
3+10HCl,
故答案为:5Cl
2+I
2+6H
2O=2HIO
3+10HCl;
(4)当加入氨水时,使该溶液变为碱性,产生BaSO
3白色沉淀(或当加入HNO
3时,使溶液中H
2SO
3氧化成H
2SO
4,产生BaSO
4白色沉淀),
故答案为:AC;当加入氨水时,使该溶液变为碱性,产生BaSO
3白色沉淀(或当加入HNO
3时,使溶液中H
2SO
3氧化成H
2SO
4,产生BaSO
4白色沉淀);
(5)由图2可知1molNO
2和1molCO反应生成CO
2和NO放出能量234kJ,反应的热化学方程式为NO
2(g)+CO(g)═CO
2(g)+NO(g)△H=-234kJ?mol
-1,
故答案为:NO
2(g)+CO(g)═CO
2(g)+NO(g)△H=-234kJ?mol
-1;
(6)盐酸肼(N
2H
6Cl
2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH
4Cl类似.
盐酸肼第一步水解反应的离子方程式为N
2H
62++H
2O?[N
2H
5?H
2O]
++H
+,
故答案为:N
2H
62++H
2O?[N
2H
5?H
2O]
++H
+.
点评:本题考查物质推断、结构性质位置关系、氧化还原反应、原电池、热化学方程式、水解等,难度中等,推断元素是关键,对基础知识掌握全面,注意(6)中为信息题,结合铵根离子的水解书写.


 ,故答案为:H-S-H;
,故答案为:H-S-H; ;
; 2Cu+4H++O2↑,故答案为:2Cu2++2H2O
2Cu+4H++O2↑,故答案为:2Cu2++2H2O 2Cu+4H++O2↑;
2Cu+4H++O2↑;