
甲、乙两瓶稀氨水的浓度分别是1mol/L和0.1mol/L,则甲、乙两瓶氨水中c(OH—)之比为
| A.大于10 | B.小于10 | C.等于10 | D.无法确定 |
科目:高中化学 来源: 题型:阅读理解

| ||
| ||
| ||
| △ |
| ||
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:
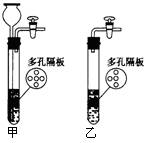 (08上海闽行区模拟) (A)(12分)实验室用图甲所示的装置制取CO2气体,可以达到随开随用,随关随停的效果:
(08上海闽行区模拟) (A)(12分)实验室用图甲所示的装置制取CO2气体,可以达到随开随用,随关随停的效果:
(1)实验前如何检查甲的气密性:
。
(2)下列气体也可以采用甲装置来制取的是____________。
A.用锌粒和稀硫酸制取氢气
B.用氢氧化钠固体和浓氨水制氨气
C.用二氧化锰和浓盐酸制取氯气
D.用电石制乙炔
(3)若用图乙装置来代替图甲制CO2气体,并要求达到与甲同样的效果(不增加仪器、用品),请叙述操作方法______________________________________________________。
(4)为了测定CO2的相对分子质量,进行如下操作:
①将收集好的CO2气体连瓶带塞一起称量,质量为m1g;
②再将此瓶重新装满空气,用塞子塞好,称量质量为m2g;
③再用此瓶收集一瓶氢气,用塞子塞好,称得质量为m3g。
所有实验均在相同条件下进行。已知:空气平均相对分子质量为29.0,试回答:
Ⅰ.本实验的测定原理是 。Ⅱ.装有CO2的集气瓶质量的称量,应重复操作,直到两次称量结果基本相同,理由是 。
Ⅲ.由实验测得CO2的相对分子质量是 。
Ⅳ.若实验测的的CO2的分子量偏小,则可能的原因是_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com