
����������(Na2S2O5)�dz��õ�ʳƷ��������֮һ��ij�о�С���������ʵ�飺
ʵ��һ ���������Ƶ���ȡ
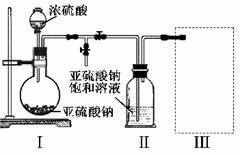 ������ͼװ��(ʵ��ǰ�ѳ���װ���ڵĿ���)��ȡNa2S2O5��װ��II����Na2S2O5���������������ķ�ӦΪ��Na2SO3��SO2��Na2S2O5
������ͼװ��(ʵ��ǰ�ѳ���װ���ڵĿ���)��ȡNa2S2O5��װ��II����Na2S2O5���������������ķ�ӦΪ��Na2SO3��SO2��Na2S2O5
��1��װ��I�в�������Ļ�ѧ����ʽΪ
��
��2��Ҫ��װ��II�л���������ľ��壬�ɲ�ȡ�ķ��뷽���� ��
��3��װ��III���ڴ���β������ѡ�õ������װ��(�г���������ȥ)Ϊ (�����)��
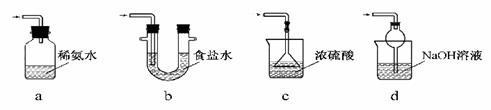
a���ⶨ��Һ��pH b������Ba(OH)2��Һ c����������
d������Ʒ����Һ e������ɫʯ����ֽ���
ʵ��� ���Ѿ��п��������������IJⶨ
��4�����ѾƳ���Na2S2O5�������������ⶨij���Ѿ��п��������IJ�����(������SO2����)�ķ������£�
 (��֪���ζ�ʱ��Ӧ�Ļ�ѧ����ʽΪSO2��I2��2H2O��H2SO4��2HI)
(��֪���ζ�ʱ��Ӧ�Ļ�ѧ����ʽΪSO2��I2��2H2O��H2SO4��2HI)
�ٰ���������ʵ�飬���ı�I2��Һ25.00 mL���ô�ʵ������Ʒ�п��������IJ�����(������SO2����)Ϊ g��L��1��
��������ʵ������У����в���HI���������������ý�� (�ƫ�ߡ���ƫ�͡����䡱)��
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������ŨH2SO4��m gͭ��ȫ��Ӧ���õ���״����n L SO2����ԭ��������(����)
A.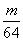 mol B.
mol B.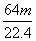 mol
mol
C.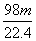 g D.
g D.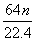 g
g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��ѧ��ӦN2+3H2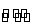 2NH3�������仯��ͼ��ʾ���÷�Ӧ���Ȼ�ѧ����ʽ��
2NH3�������仯��ͼ��ʾ���÷�Ӧ���Ȼ�ѧ����ʽ��
( )

A��N2(g)+3H2(g)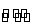 2NH3(l) ��H=2(a-b-c) kJ��mol-1
2NH3(l) ��H=2(a-b-c) kJ��mol-1
B��N2(g)+3H2(g)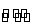 2NH3(g) ��H=2(b-a) kJ��mol-1
2NH3(g) ��H=2(b-a) kJ��mol-1
C��1/2N2(g)+3/2H2(g)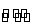 NH3(l) ��H=(b+c-a) kJ��mol-1
NH3(l) ��H=(b+c-a) kJ��mol-1
D��1/2N2(g)+3/2H2(g)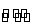 NH3(g) ��H=(a+b) kJ��mol-1
NH3(g) ��H=(a+b) kJ��mol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�������ӷ���ʽ��д��ȷ����
A.����ͨ��ˮ��H2O+ Cl2 2H+ + Cl-+ ClO-
B.�Ȼ�����Һ�м�������2Fe3+ + Fe 3Fe2+
C.̼��Ƽ��������� C032-+2H+��CO2��+H2O
D.ͭƬ����ϡ������Cu + 2 H+ = Cu2++H2��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��Ȼ�ֽ��IJ�����̼�⻯�������C��88.2%��H��11.8%�����������Է���������68�������Ļ�ѧʽ��������0.5mol�ܺ�160gBr2��ӳɷ�Ӧ��������������ԭ�ӷֲ��ڲ�ͬ��̼ԭ���ϣ���֪�����Ľṹ����һ��̼ԭ������֧���ϣ�������������д������ķ���ʽ���ṹ��ʽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��NAΪ����٤������������������ȷ���� �� ��
A��1mol�״��к���C-H������ĿΪ4NA
B����״���£�2.24L���麬�з��ӵ���ĿΪ0.1NA
C��12�˽��ʯ�к��еĹ��ۼ���ĿΪ2NA
D��1 mol �������ĵ�����Ϊ10NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
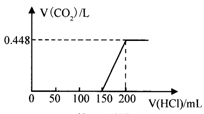
��¶���ڿ����е�ij�������ƹ�����Ʒ����ˮ����������Һ����μ���ϡ���������������ɵ�CO2�������״���������������������ͼ��ϵ��������CO2��ˮ�е��ܽ⣩���Լ��㣺��������д���㲽�裩
(1)��������ʵ���Ũ��Ϊ mol/L��
(2)����Ʒ��NaOH��Na2CO3���ʵ���֮��Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A��B��C��X��Ϊ�����Ĵ��������֮��������ת����ϵ������Ʒ����ȥ����
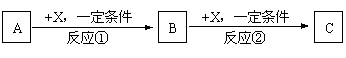 |
�Իش�
��1����X��ǿ�����Ե��ʣ���A�������� ��
a. S b. N2 c. Na d. Mg e. Al
��2����X�ǽ������ʣ���C��ˮ��Һ�е���AgNO3��Һ������������ϡHNO3�İ�ɫ�����������C��Һ�н���Ԫ�ؼ�̬�IJ��������ǣ� ����B�Ļ�ѧʽΪ ��
��3����A��B��CΪ��ij����Ԫ�ص��������XΪǿ����ʣ�A��Һ��C��Һ��Ӧ����B��BΪ���Ի������X�Ļ�ѧʽ����Ϊ��д����ͬ�����ʣ� �� ��
��Ӧ�ٵ����ӷ���ʽΪ��дһ���� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com