
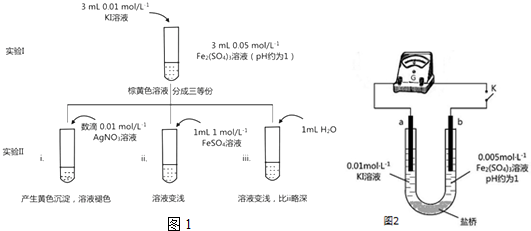
 新能源开发中的燃料电池是低碳研究的重要领域.
新能源开发中的燃料电池是低碳研究的重要领域.分析 (一)燃料电池中,负极是燃料发生失电子的氧化反应,正极上是氧气得电子的还原反应,据此书写电极反应式;
A、燃料电池中,通入燃料的电极是负极;
B、电池工作时电流由正极沿导线到负极;
C、燃料电池中,阳离子从负极移向正极;
D.根据电池反应来确定电子转移的数目.
(二)原电池中,较活泼金属做负极,较不活泼金属或非金属做正极,铝较活泼,易被氧化而失去电子,应做原电池的负极,正极上氧气得电子发生还原反应;
(1)称量质量用到的仪器是托盘天平;
(2)样品中能与盐酸反应的是镁和;铜和硅与盐酸不反应;根据溶解、过滤时用到的玻璃仪器来回答;
(3)氢氧化铝沉淀烘干并灼烧至质量不再减少为止,得到的质量为bg的是氧化铝,根据铝元素守恒来计算合金中铝的含量.
解答 解:(一)在燃料电池中,正极上是氧气发生得电子的反应还原反应,O2+2H2O+4e-=4OH-,负极是燃料CxHyOz发生失电子的氧化反应,正极加上负极反应即为总的燃料燃烧反应方程式;A、燃料电池中,通入燃料二甲醚的电极a是负极,故A正确;
B、电池工作时电流由正极b沿导线到负极a,故B正确;
C、燃料电池中,阳离子从负极移向正极,溶液中的质子通过交换膜由a极移向b极,故C错误;
D.根据电池反应CH3OCH3+3O2=2CO2+3H2O可知道电子转移的数目是12,故D错误.
故选CD;故答案为:O2+2H2O+4e-=4OH-;CD;
(二)铝是活泼金属,易被氧化而失去电子,应做原电池的负极,电极反应式为Al-3e-=Al3+,正极上氧气得电子发生还原反应,电极反应式为O2+2H2O+4e-=4OH-,该电池的总反应为正极和负极反应之和,即:4Al+3O2+6H2O=4Al(OH)3,故答案为:4Al+3O2+6H2O=4Al(OH)3.
(1)称量质量用到的仪器是托盘天平,故答案为:托盘天平;
(2)样品中能与盐酸反应的是镁和,铜和硅与盐酸不反应,将样品溶于足量的稀盐酸中,过滤,滤液中主要含有Mg2+、Al3+,滤渣中含有铜和硅,溶解、过滤时用到的玻璃仪器有:漏斗、玻璃棒、烧杯,故答案为:Mg2+、Al3+;铜和硅;漏斗、玻璃棒、烧杯.
(3)氢氧化铝沉淀烘干并灼烧至质量不再减少为止,得到的质量为bg的是氧化铝,根据铝元素守恒,合金中铝元素的质量分数是:$\frac{bg×\frac{54}{102}×100%}{a}$×100%=$\frac{9b}{17a}$×100%,故答案为:$\frac{9b}{17a}$×100%.
点评 本题考查了原电池、燃料电池的工作原理,明确正负极上得失电子及反应式的书写即可解答,难度不大,注意知识的归纳和梳理是关键.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图是一种正在投入生产的大型蓄电系统的原理图.电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜只允许钠离子通过.电池充、放电的化学反应方程式为:2Na2S2+NaBr3$?_{放电}^{充电}$Na2S4+3NaBr.下列关于此电池说法正确的是( )
如图是一种正在投入生产的大型蓄电系统的原理图.电池中的左右两侧为电极,中间为离子选择性膜,在电池放电和充电时该膜只允许钠离子通过.电池充、放电的化学反应方程式为:2Na2S2+NaBr3$?_{放电}^{充电}$Na2S4+3NaBr.下列关于此电池说法正确的是( )| A. | 充电的过程中当0.1molNa+通过离子交换膜时,导线通过0.2mol电子 | |
| B. | 放电过程中钠离子从右到左通过离子交换膜 | |
| C. | 电池放电时,负极反应为:3NaBr-2e-=NaBr3+2Na+ | |
| D. | 充电过程中钠离子从右到左通过离子交换膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述反应既属于氧化还原反应,又属于离子反应 | |
| B. | 生成1 mol Cl2转移电子数均为2NA | |
| C. | 盐酸浓度越大,Cl-的还原性越强 | |
| D. | 氧化性:KMnO4>K2Cr2O7>Cl2>MnO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | CH3OH的燃烧热为192.9kJ/mol | |
| B. | 由上述原理可推知H2的燃烧热为241.9 kJ/mol | |
| C. | 反应②中的能量变化可用图表示: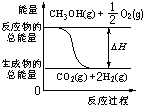 | |
| D. | CH3OH转变成H2的过程一定要吸收能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 | B. | 3 | C. | 4 | D. | 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 PM2.5污染与直接排放化石燃烧产生的烟气有关,化石燃料燃烧同时放出大量的SO2和NOx.
PM2.5污染与直接排放化石燃烧产生的烟气有关,化石燃料燃烧同时放出大量的SO2和NOx.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( )
利用如图所示装置,当X、Y选用不同材料时,可将电解原理广泛应用于工业生产.下列说法中正确的是( )| A. | 外加电流的阴极保护法中,Y是待保护金属 | |
| B. | 铜的精炼中,X是纯铜,Y是粗铜,Z是CuSO4 | |
| C. | 电镀工业中,X是待镀金属,Y是镀层金属 | |
| D. | 氯碱工业中,X、Y均为石墨,X附近能得到氢氧化钠 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com