

 +O2$”ś_{”÷}^{“߻ƼĮ}$2
+O2$”ś_{”÷}^{“߻ƼĮ}$2 +2H2O£»Ęä·“Ó¦ĄąŠĶŹĒŃõ»Æ·“Ó¦£»
+2H2O£»Ęä·“Ó¦ĄąŠĶŹĒŃõ»Æ·“Ó¦£»·ÖĪö øł¾Ż·“Ó¦¢Ū²śĪļµÄ½į¹¹¼ņŹ½£¬æÉÖŖ£¬C4H7ClµÄ½į¹¹Ź½ĪŖ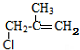 £¬ÓÉ·“Ó¦¢ŚµÄĢõ¼žæÉÖŖ£¬C4H8Cl2ĶŃČ„1·Ö×ÓHCl·¢ÉśĻūČ„·“Ӧɜ³É
£¬ÓÉ·“Ó¦¢ŚµÄĢõ¼žæÉÖŖ£¬C4H8Cl2ĶŃČ„1·Ö×ÓHCl·¢ÉśĻūČ„·“Ӧɜ³É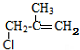 £¬ŌņC4H8Cl2µÄ½į¹¹Ź½ĪŖ
£¬ŌņC4H8Cl2µÄ½į¹¹Ź½ĪŖ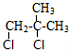 £¬½įŗĻ·“Ó¦¢ŁæÉÖŖ£¬C4H8ŗ¬ÓŠC=CĖ«¼ü£¬ÓėĀČĘų·¢Éś¼Ó³É·“Ӧɜ³É
£¬½įŗĻ·“Ó¦¢ŁæÉÖŖ£¬C4H8ŗ¬ÓŠC=CĖ«¼ü£¬ÓėĀČĘų·¢Éś¼Ó³É·“Ӧɜ³É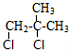 £¬ŌņC4H8µÄ½į¹¹Ź½ĪŖ
£¬ŌņC4H8µÄ½į¹¹Ź½ĪŖ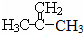 £»·“Ó¦¢ŽĪŖ“¼µÄ“ß»ÆŃõ»Æ£¬ĖłŅŌÉś³ÉµÄ²śĪļĪŖ£ŗ
£»·“Ó¦¢ŽĪŖ“¼µÄ“ß»ÆŃõ»Æ£¬ĖłŅŌÉś³ÉµÄ²śĪļĪŖ£ŗ £¬ŌŁ±»Ņų°±ČÜŅŗŃõ»ÆŗóĖį»ÆµĆµ½H£¬¹ŹHĪŖ
£¬ŌŁ±»Ņų°±ČÜŅŗŃõ»ÆŗóĖį»ÆµĆµ½H£¬¹ŹHĪŖ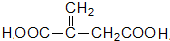 £¬¾Ż“Ė½ā“š£®
£¬¾Ż“Ė½ā“š£®
½ā“š ½ā£ŗøł¾Ż·“Ó¦¢Ū²śĪļµÄ½į¹¹¼ņŹ½£¬æÉÖŖ£¬C4H7ClµÄ½į¹¹Ź½ĪŖ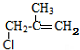 £¬ÓÉ·“Ó¦¢ŚµÄĢõ¼žæÉÖŖ£¬C4H8Cl2ĶŃČ„1·Ö×ÓHCl·¢ÉśĻūČ„·“Ӧɜ³É
£¬ÓÉ·“Ó¦¢ŚµÄĢõ¼žæÉÖŖ£¬C4H8Cl2ĶŃČ„1·Ö×ÓHCl·¢ÉśĻūČ„·“Ӧɜ³É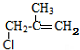 £¬ŌņC4H8Cl2µÄ½į¹¹Ź½ĪŖ
£¬ŌņC4H8Cl2µÄ½į¹¹Ź½ĪŖ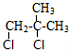 £¬½įŗĻ·“Ó¦¢ŁæÉÖŖ£¬C4H8ŗ¬ÓŠC=CĖ«¼ü£¬ÓėĀČĘų·¢Éś¼Ó³É·“Ӧɜ³É
£¬½įŗĻ·“Ó¦¢ŁæÉÖŖ£¬C4H8ŗ¬ÓŠC=CĖ«¼ü£¬ÓėĀČĘų·¢Éś¼Ó³É·“Ӧɜ³É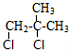 £¬ŌņC4H8µÄ½į¹¹Ź½ĪŖ
£¬ŌņC4H8µÄ½į¹¹Ź½ĪŖ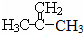 £»·“Ó¦¢ŽĪŖ“¼µÄ“ß»ÆŃõ»Æ£¬ĖłŅŌÉś³ÉµÄ²śĪļĪŖ£ŗ
£»·“Ó¦¢ŽĪŖ“¼µÄ“ß»ÆŃõ»Æ£¬ĖłŅŌÉś³ÉµÄ²śĪļĪŖ£ŗ £¬ŌŁ±»Ņų°±ČÜŅŗŃõ»ÆŗóĖį»ÆµĆµ½H£¬¹ŹHĪŖ
£¬ŌŁ±»Ņų°±ČÜŅŗŃõ»ÆŗóĖį»ÆµĆµ½H£¬¹ŹHĪŖ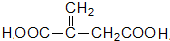 £¬
£¬
£Ø1£©ÓÉÉĻŹö·ÖĪöæÉÖŖ£¬C4H8ĪŖ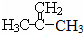 £¬Ćū³ĘŹĒ2-¼×»ł-1-±ūĻ©£»C4H7ClµÄ½į¹¹Ź½ĪŖ
£¬Ćū³ĘŹĒ2-¼×»ł-1-±ūĻ©£»C4H7ClµÄ½į¹¹Ź½ĪŖ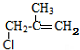 £¬C4H7ClÖŠŗ¬ÓŠµÄ¹ŁÄÜĶŵÄĆū³ĘŹĒĀČŌ×ÓŗĶĢ¼Ģ¼Ė«¼ü£¬
£¬C4H7ClÖŠŗ¬ÓŠµÄ¹ŁÄÜĶŵÄĆū³ĘŹĒĀČŌ×ÓŗĶĢ¼Ģ¼Ė«¼ü£¬
¹Ź“š°øĪŖ£ŗ2-¼×»ł-1-±ūĻ©£»ĀČŌ×ÓŗĶĢ¼Ģ¼Ė«¼ü£»
£Ø2£©ÓÉÉĻŹö·ÖĪöæÉÖŖ£¬HĪŖ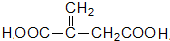 £¬ĘäÖŠŗ¬ÓŠµÄ¹ŁÄÜĶŵÄĆū³ĘŹĒōČ»ł”¢Ģ¼Ģ¼Ė«¼ü£»·“Ó¦¢ŪĪŖČ”“ś·“Ó¦£¬
£¬ĘäÖŠŗ¬ÓŠµÄ¹ŁÄÜĶŵÄĆū³ĘŹĒōČ»ł”¢Ģ¼Ģ¼Ė«¼ü£»·“Ó¦¢ŪĪŖČ”“ś·“Ó¦£¬
¹Ź“š°øĪŖ£ŗōČ»ł”¢Ģ¼Ģ¼Ė«¼ü£»Č”“ś·“Ó¦£»
£Ø3£©·“Ó¦¢ŁµÄ»Æѧ·½³ĢŹ½ĪŖ£Ø CH3£©2C=CH2+Cl2”ś£Ø CH3£©2CClCH2Cl£¬
¹Ź“š°øĪŖ£ŗ£Ø CH3£©2C=CH2+Cl2”ś£Ø CH3£©2CClCH2Cl£»
£Ø4£©·“Ó¦¢ŽµÄ»Æѧ·½³ĢŹ½ĪŖ2 +O2$”ś_{”÷}^{“߻ƼĮ}$2
+O2$”ś_{”÷}^{“߻ƼĮ}$2 +2H2O£¬øĆ·“Ó¦ĪŖŃõ»Æ·“Ó¦£¬
+2H2O£¬øĆ·“Ó¦ĪŖŃõ»Æ·“Ó¦£¬
¹Ź“š°øĪŖ£ŗ2 +O2$”ś_{”÷}^{“߻ƼĮ}$2
+O2$”ś_{”÷}^{“߻ƼĮ}$2 +2H2O£»Ńõ»Æ·“Ó¦£»
+2H2O£»Ńõ»Æ·“Ó¦£»
£Ø5£©HĪŖ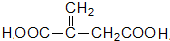
a£®ŅņĪŖŗ¬ÓŠĢ¼Ģ¼Ė«¼ü£¬ĖłŅŌÄÜŹ¹ĖįŠŌKMnO4ČÜŅŗ»ņäåµÄCCl4ČÜŅŗĶŹÉ«£¬¹ŹaÕżČ·£»
b£®ŅņĪŖŗ¬ÓŠōČ»ł£¬ĖłŅŌÄÜÓėNa2CO3·“Ó¦£¬µ«ŗ¬ÓŠĢ¼Ģ¼Ė«¼ü£¬Ņ²æÉÓėHBr·“Ó¦£¬¹Źb“ķĪó£»
c£®ŅņĪŖŗ¬ÓŠōČ»ł£¬ĖłŅŌÄÜÓėŠĀÖĘCu£ØOH£©2·“Ó¦£¬¹ŹcÕżČ·£»
d£®øł¾ŻH·Ö×ÓŹ½ĪŖC5H6O4£¬Ōņ1mol HĶźČ«Č¼ÉÕĻūŗÄ4.5mol O2£¬¹Źd“ķĪó£»
¹ŹŃ”£ŗac£»
£Ø4£©ŅĀæµĖįĪŖ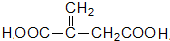 £¬ÓŠ¶ąÖÖĶ¬·ÖŅģ¹¹Ģ壬ĘäÖŠÓŠŅ»ÖÖŗĖ“Ź²ÕńĒāĘ×ÓŠ5øö·å£¬ĖµĆ÷ĆæøöĢ¼ÉĻŅ»ÖÖĒā£¬½į¹¹²»¶Ō³Ę£¬ĖłŅŌĘä½į¹¹¼ņŹ½HOOCCH=CHCH2COOH£¬
£¬ÓŠ¶ąÖÖĶ¬·ÖŅģ¹¹Ģ壬ĘäÖŠÓŠŅ»ÖÖŗĖ“Ź²ÕńĒāĘ×ÓŠ5øö·å£¬ĖµĆ÷ĆæøöĢ¼ÉĻŅ»ÖÖĒā£¬½į¹¹²»¶Ō³Ę£¬ĖłŅŌĘä½į¹¹¼ņŹ½HOOCCH=CHCH2COOH£¬
¹Ź“š°øĪŖ£ŗHOOCCH=CHCH2COOH£®
µćĘĄ ±¾Ģāæ¼²éÓŠ»śĪļµÄĶʶĻÓėŗĻ³É£¬ŠčŅŖ¶ŌøųÓčµÄ½į¹¹½ųŠŠĄūÓĆ£¬ÄܽĻŗƵÄæ¼²éæ¼ÉśµÄŌĶĮ”¢×ŌѧÄÜĮ¦ŗĶĖ¼Ī¬ÄÜĮ¦£¬ŹĒČȵćĢāŠĶ£®×¢Ņāøł¾ŻÓŠ»śĪļµÄ·Ö×ÓŹ½Óė½į¹¹½ųŠŠĶʶĻ£¬HµÄ½į¹¹ĶʶĻŹĒ±¾ĢāµÄÄŃµć£®



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
 ¶ŌÓŚĆܱÕČŻĘ÷ÖŠµÄ·“Ó¦£ŗN2£Øg£©+3H2£Øg£©?2NH3£Øg£©£¬”÷H£¼0ŌŚ400”ę2MPaĻĀ£¬n£ØNH3£©ŗĶn£ØH2£©Ėꏱ¼ä±ä»ÆµÄ¹ŲĻµČēĶ¼ĖłŹ¾£¬ĻĀĮŠŠšŹöÕżČ·µÄŹĒ£Ø””””£©
¶ŌÓŚĆܱÕČŻĘ÷ÖŠµÄ·“Ó¦£ŗN2£Øg£©+3H2£Øg£©?2NH3£Øg£©£¬”÷H£¼0ŌŚ400”ę2MPaĻĀ£¬n£ØNH3£©ŗĶn£ØH2£©Ėꏱ¼ä±ä»ÆµÄ¹ŲĻµČēĶ¼ĖłŹ¾£¬ĻĀĮŠŠšŹöÕżČ·µÄŹĒ£Ø””””£©| A£® | µćaµÄÕż·“Ó¦ĖŁĀŹ±ČµćbµÄŠ” | |
| B£® | µćc“¦·“Ó¦“ļµ½Ę½ŗā | |
| C£® | µćdŗĶµće“¦n£ØN2£©²»Ņ»Ńł | |
| D£® | ĘäĖūĢõ¼ž²»±ä£¬500”ęĻĀ·“Ó¦ÖĮt1Ź±æĢ£¬n£ØH2£©±ČĶ¼ÖŠµćdµÄÖµ“ó |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ČÜŅŗÖŠŗ¬ÓŠ1 mol NaCl | B£® | 1 mol NaClČÜÓŚ1 LĖ®ÖŠ | ||
| C£® | 58.5 g NaClČÜÓŚ941.5 gĖ®ÖŠ | D£® | 1 LČÜŅŗÖŠŗ¬ÓŠNaCl 58.5 g |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | +1 | B£® | +2 | C£® | +3 | D£® | +4 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ąė×Ó°ė¾¶£ŗX+£¾Y3+£¾Z2- | B£® | Ō×ÓŠņŹż£ŗY£¾X£¾Z | ||
| C£® | µēøŗŠŌ£ŗZ£¾Y£¾X | D£® | µ„ÖŹµÄ»¹ŌŠŌ£ŗX£¾Y |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 A”¢B”¢C”¢D¾łŹĒÓɶĢÖÜĘŚŌŖĖŲŠĪ³ÉµÄĖÄÖÖĘųĢåµ„ÖŹ£¬E”¢F¾łĪŖĘųĢ壬ĒŅFĪŖŗģ×ŲÉ«£®ÓŠ¹ŲµÄ×Ŗ»Æ¹ŲĻµČēĶ¼ĖłŹ¾£Ø·“Ó¦Ģõ¼ž¾łŅŃĀŌČ„£©£ŗ
A”¢B”¢C”¢D¾łŹĒÓɶĢÖÜĘŚŌŖĖŲŠĪ³ÉµÄĖÄÖÖĘųĢåµ„ÖŹ£¬E”¢F¾łĪŖĘųĢ壬ĒŅFĪŖŗģ×ŲÉ«£®ÓŠ¹ŲµÄ×Ŗ»Æ¹ŲĻµČēĶ¼ĖłŹ¾£Ø·“Ó¦Ģõ¼ž¾łŅŃĀŌČ„£©£ŗ²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ĒāŃõ»Æ±µČÜŅŗÓėĻ”ĮņĖį·“Ó¦£ŗBa2++SO42-+H++OH-ØTBaSO4”ż+H2O | |
| B£® | µķ·Ūµā»Æ¼ŲČÜŅŗŌŚæÕĘųÖŠ±äĄ¶£ŗ4I-+O2+2H2OØT4OH-+2I2 | |
| C£® | ĻņNa2SO3ČÜŅŗÖŠµĪ¼ÓĻ”ĻõĖį£ŗSO32-+2H+ØTSO2”ü+H2O | |
| D£® | ÓĆ°±Ė®ĪüŹÕ×ćĮæµÄCO2ĘųĢå£ŗOH-+CO2ØTHCO3- |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¶ąŃ”Ģā
| A£® | FeOÓėĻ”ĻõĖį·“Ó¦£ŗFeO+2H+ØTFe2++H2O | |
| B£® | £ØNH4£©2Fe£ØSO4£©2ČÜŅŗÓė¹żĮæNaOHČÜŅŗ·“Ó¦£ŗFe2++2OH-ØTFe£ØOH£©2”ż | |
| C£® | äå»ÆŃĒĢśČÜŅŗÖŠĶØČė×ćĮæĀČĘų£ŗ2Fe2++4Br-+3Cl2ØT2Fe3++2 Br2+6Cl- | |
| D£® | ĻņFeCl3ČÜŅŗÖŠ¼ÓČėMg£ØOH£©2£ŗ3Mg£ØOH£©2+2Fe3+ØT2Fe£ØOH£©3+3Mg2+ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 ijĪĀ¶ČĻĀµÄČÜŅŗÖŠ£¬c £ØH+£©=10x mol/L£¬c £ØOH-£©=10y mol/L£®
ijĪĀ¶ČĻĀµÄČÜŅŗÖŠ£¬c £ØH+£©=10x mol/L£¬c £ØOH-£©=10y mol/L£®²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com