
设NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,22.4L己烷中含己烷分子数目为NA
B.28g由乙烯和丙烯组成的混合气体中含碳碳双键数目为NA
C.71gNa2SO4固体中含钠离子数目为NA
D.25g质量分数68%的H2O2水溶液中含氧原子数目为NA
 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源:2014-2015学年四川省广安市高三“一诊”理综化学试卷(解析版) 题型:实验题
(15分)铁、铜等金属及其化合物在日常生产生活中用途非常广泛。
Ⅰ.实验室欲制备0.3 mol Cu (NO3)2晶体,甲、乙两同学分别设计实验方案如下:
甲:Cu  Cu(NO3)2
Cu(NO3)2
乙:Cu  CuO
CuO  Cu(NO3)2
Cu(NO3)2
(1)从绿色化学的角度分析, 同学的方案更合理。
(2)乙同学实验时通入O2的速率不宜过大,为便于观察和控制产生O2的速率,宜选择 装置(填字母序号)。
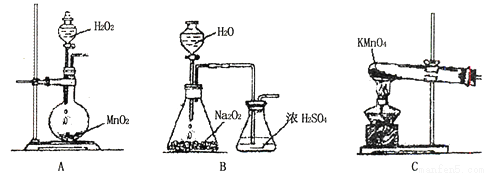
Ⅱ.某化学实验小组通过实验来探究一包黑色粉是否由Fe3O4、CuO组成
探究过程如下:
(1)提出假设:假设1. 黑色粉末是CuO;
假设2. 黑色粉末是Fe3O4;
假设3. 黑色粉末是CuO和Fe3O4的混合物。
(2)设计探究实验:
取少量粉末放入足量稀硫酸中,在所得溶液中滴加KSCN试剂。
①若假设1成立,则实验现象是溶液显蓝色。
②若假设2或3成立,则实验现象是 。
为进一步探究,继续向所得溶液加入足量铁粉,若产生 的现象,则假设3成立。
有另一小组同学提出,若混合物中CuO含量较少,可能加入铁粉后实验现象不明显。
查阅资料:Cu2+与足量氨水反应生成深蓝色溶液,Cu2++4NH3·H2O=Cu(NH3)42++4H2O。
为探究是假设2还是假设3成立,另取少量粉末加稀硫酸充分溶解后,再加入足量氨水,若假设2成立,则产生 现象;若假设3成立,则产生 现象。
III.由Fe3O4、FeO、CuO、Fe组成的固体混合物,在加热条件下用足量的CO还原,得到金属混合物2.86g,将生成的CO2气体用足量的澄清石灰水吸收后,产生5.00g白色沉淀。固体混合物的质量是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省高三质量检测化学试卷(解析版) 题型:选择题
室温时,盐酸和硫酸的混合溶液20mL,向混合物中逐滴加入0.05mol·L-1Ba(OH)2溶液时,生成的BaSO4和pH的变化如图所示(不考虑溶液混合时体积的变化)。下列说法正确的是

A.图中A点对应溶液的pH:a=1
B.生成沉淀的最大质量m=2.33g
C.原混合液中c(HCl)=0.2mol·L-1
D.当V[Ba(OH)2(aq)]=30mL时,有关离子浓度大小:c(Cl-)>c(Ba2+)>c(H+)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省南京市、盐城市高三一模化学试卷(解析版) 题型:计算题
(12分)化学需氧量(COD)常作为衡量水体中有机物含量多少的指标。某化学课外小组的同学拟采用碱性高锰酸钾溶液测定某海水试样的COD,实验流程如下:

已知:①弱碱性条件下MnO4-被还原性物质还原为MnO2
②10I-+2MnO4-+16H+=5I2+2Mn2++8H2O
③2S2O32-+I2=2I-+S4O62-
(1)测定海水试样的COD,采用碱性高锰酸钾溶液而不采用酸性高锰酸钾溶液,其可能原因是 。
(2)氧化后的水样煮沸后,需冷却并在暗处再加入KI和硫酸,需在暗处的原因是 。用Na2S2O3,标准溶液滴定,终点时溶液颜色的变化是 。
(3)滴定到终点时消耗Na2S2O3标准溶液10.00mL。根据以上实验数据计算海水试样的COD(用每升 水样相当于消耗多少毫克O2表示,单位:mg?L-1)(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省南京市、盐城市高三一模化学试卷(解析版) 题型:选择题
下列有关说法正确的是
A.铅蓄电池放电时,正极和负极的电极质量均增大
B.反应Cl2(g)+H2O(1)=HCl(aq)+HClO(aq)在常温下能自发进行,则该反应的△H>0
C.加热Fe2(SO4)3溶液,Fe3+的水解程度和溶液的pH均增大
D.C2H5Br水解生成乙醇(△H>0),加入少量NaOH浓溶液并加热,该化学反应速率增大其平衡常数不变
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省南京市、盐城市高三一模化学试卷(解析版) 题型:选择题
最近我国科学家研究发现人体中微量的H2S能有效预防心脏病、老年性痴呆症。下列有关H2S的说法正确的是
A.H2S属于非电解质 B.人体内H2S可由含硫蛋白质降解产生
C.大量吸入H2S对人体无害 D.H2S只有还原性没有氧化性
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省连云港等四市高三一模化学试卷(解析版) 题型:填空题
(12分)粉煤灰是燃煤电厂的废渣,主要成分为SiO2、Al2O3、Fe2O3和C等。实验室模拟工业从粉煤灰提取活性Al2O3,其流程如下图:
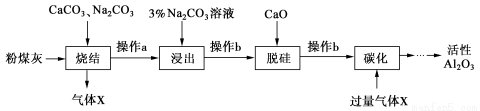
已知烧结过程的产物主要是:NaAlO2、Ca2SiO4、NaFeO2和Na2SiO3等
(1)写出烧结过程中铝元素转化的化学方程式 。
(2)操作a为冷却、研磨,其中研磨的目的是 。
(3)浸出过程中,NaFeO2可完全水解,水解反应的离子方程式为 。
(4)操作b的名称是 ,所用的玻璃仪器有 、 和烧杯。
(5)“碳化”时生成沉淀,沉淀的化学式为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏常州市高三第一次调研试卷化学试卷(解析版) 题型:填空题
(14分)某化工厂以软锰矿、闪锌矿(除主要成分为MnO2、ZnS外还含有少量的FeS、CuS、Al2O3等物质)为原料制取Zn和MnO2。
(1)在一定条件下,将这两种矿粉在硫酸溶液中相互作用,配平如下的化学方程式:
MnO2 + FeS + H2SO4 MnSO4 + Fe2(SO4)3 + S + H2O
MnSO4 + Fe2(SO4)3 + S + H2O
(2)将所得含有Mn2+、Fe3+、Cu2+、Al3+、Zn2+的酸性溶液按以下的工业流程进行操作处理得溶液(IV),电解溶液(IV)即得MnO2和Zn。

a.操作①中加Zn粉后发生反应的离子方程式为 。
b.操作②中加入适量X的作用是什么 ;X的首选物的化学式是 。
c.操作③中所加碳酸盐的化学式是 。
(3)为了从上述流程中产生的Fe(OH)3、Al(OH)3沉淀混合物中回收Al(OH)3,工厂设计了如下的有关流程图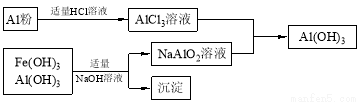
a.AlCl3溶液和NaAlO2溶液反应生成AI(OH)3的离子方程式为 ,若总共得到n molAl(OH)3,则消耗的NaOH和HCl的理论量(mol)分别为 、 。
b.若使用下列流程回收处理,请比较两个流程消耗酸碱的用量?

查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省深圳市高三第一次调研考试理综化学试卷(解析版) 题型:选择题
下列陈述Ⅰ、Ⅱ正确并且有因果关系的是
选项 | 陈述I | 陈述II |
A | KSCN可用来检验Fe3+ | 用KSCN溶液检验FeSO4是否变质 |
B | 盐的水解是吸热反应 | 加热可提高水解反应速率 |
C | H2O2有氧化性 | 双氧水能使酸性KMnO4溶液褪色 |
D | Al(OH)3是两性氢氧化物 | Al(OH)3可溶于过量浓氨水中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com