
下列溶液中各微粒的浓度关系错误的是 ( )
A.0.1 mol·L-1 CH3COOH溶液中:c(CH3COO-)+c(OH-)=c(H+)
B.0.1 mol·L-1 NaHCO3溶液中:c(H+)+c(H2CO3)=c(CO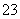 )+c(OH-)
)+c(OH-)
C.25℃时,有等浓度的①NH4HSO4溶液、②NH4HCO3溶液中c(NH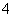 ):①>②
):①>②
D.含等物质的量的NaX和弱酸(HX)混合溶液中一定存在:c(Na+)>c(X-)
科目:高中化学 来源: 题型:
肼是重要的化工原料。某探究小组利用下
列反应制取水合肼(N2H4·H2O)。
CO(NH2)2+ 2NaOH + NaClO = Na2CO3 + N2H4·H2O + NaCl
实验一: 制备NaClO溶液。(实验装置如右图所示)

(1)配制30%NaOH溶液时,所需玻璃仪器除量筒外还有 (填标号)。
A.容量瓶 B.烧杯 C.烧瓶 D.玻璃棒
(2) 锥形瓶中发生反应的化学方程式是 。
(3) 因后续实验需要,需利用中和滴定原理测定反应后锥形瓶中混合溶液的NaOH的浓
度。请选用所提供的试剂(H2O2溶液、FeCl2溶液、0.1000mol·L-1盐酸、酚酞试液),设计实
验方案。 。
实验二: 制取水合肼。(实验装置如右图所示)控制反应温度,将分液漏斗中溶液缓慢滴入
三颈烧瓶中,充分反应。加热蒸馏三颈烧瓶内的溶液,收集108~114℃馏分。(已知:N2H4·H2O + 2NaClO = N2↑ + 3H2O + 2NaCl)

(4)分液漏斗中的溶液是 (填标号)。
A.CO (NH2) 2溶液 B.NaOH和NaClO混合溶液
选择的理由是 。
实验三: 测定馏分中肼含量。
称取馏分5.000g,加入适量NaHCO3固体,加水配成250mL溶液,移出25.00mL,用0.1000mol·L-1的I2溶液滴定。滴定过程中,溶液的pH保持在6.5左右。
(已知:N2H4·H2O + 2I2 = N2↑+ 4HI + H2O)
(5)滴定过程中,NaHCO3能控制溶液的pH在6.5左右,原因是 。
(6)实验测得消耗I2溶液的平均值为18.00mL,馏分中水合肼(N2H4·H2O)的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
“哥伦比亚号”航天飞机的失事原因之一是覆盖在航天飞机外层的一片微不足道的隔热瓦脱离,引起飞机外表金属温度迅速升高而熔化解体。
其中照片显示,在“哥伦比亚号”机翼下方有几片小瓷片脱落,引起了科学家的注意,这是一种覆盖在航天飞机表面的特殊的陶瓷片,其主要作用是________。
A.增加航天飞机的强度,防止流星和太空垃圾撞击而损坏航天飞机
B.将太阳能转化为电能供航天飞机使用
C.便于雷达跟踪,接受地面指挥中心的指令
D.在返回大气层时,陶瓷耐高温隔热,有效地保护航天飞机平安返回地面
(2)隔热瓦是一种金属陶瓷,金属陶瓷是由陶瓷和黏结金属组成的非匀质的复合材料。下列关于复合材料的说法不正确的是________。
A.由两种或两种以上金属(或金属与非金属)熔合而成的物质叫复合材料
B.复合材料一般具有强度高、质量轻、耐高温、耐腐蚀等优异功能,在综合性能上超过了单一材料
C.玻璃钢是以玻璃纤维和树脂组成的复合材料,它可做船体,汽车车身等,也可做印刷电路板
D.复合材料的熔、沸点一般比它的各组成成分的熔、沸点低
查看答案和解析>>
科目:高中化学 来源: 题型:
下列事实不能用勒夏特列原理解释的是 ( )
A.开启啤酒瓶后,瓶中立刻泛起大量泡沫
B.由H2、I2蒸气、HI组成的平衡体系加压后颜色变深
C.向氯水中加CaCO3后,溶液漂白性增强
D.用排饱和食盐水法收集氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
已知化学反应A2(g)+B2(g)===2AB(s)的能量变化如图所示,判断下列叙述中错误的是( )
A.该反应热ΔH=(a-b)kJ·mol-1
B.AB(g)=== A(g)+B(g) ΔH=b/2kJ·mol-1
C.断裂1 mol A-A键和1 mol B-B键,吸收a kJ能量
D.该反应在任何条件下都不可能自发进行

查看答案和解析>>
科目:高中化学 来源: 题型:
甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应反应来制备甲醇。
I:CH4 ( g ) + H2O ( g ) =CO ( g ) + 3H2 (g ) △H =+206.0 kJ·mol-1
II:CO ( g ) + 2H2 ( g ) = CH3OH ( g ) △H =—129.0 kJ·mol-1
(1)CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为 。
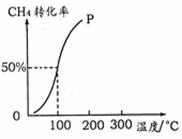 (2)将1.0 mol CH4和2.0 mol H2O ( g )通入容积为100 L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的
(2)将1.0 mol CH4和2.0 mol H2O ( g )通入容积为100 L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的
关系如右图。
①假设100 ℃时达到平衡所需的时间为5 min,
则用H2表示该反应的平均反应速率为 。
②100℃时反应I的平衡常数为 。
(3)在压强为0.1 MPa、温度为300℃条件下,将a mol CO与
3a mol H2的混合气体在催化剂作用下发生反应II生成甲醇,平衡后将容器的容积压缩到原来的l/2,其他条件不变,对平衡体系产生的影响是 ▲ (填字母序号)。
A.c ( H2 )减少 B.正反应速率加快,逆反应速率减慢 C.CH3OH 的物质的量增加 D.重新平衡c ( H2 )/ c (CH3OH )减小 E.平衡常数K增大
(4)写出甲醇—空气—KOH溶液的燃料电池负极的电极反应式: 。
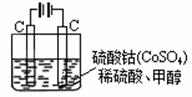 (5)甲醇对水质会造成一定的污染,有一种电化学法可消除
(5)甲醇对水质会造成一定的污染,有一种电化学法可消除
这种污染,其原理是:通电后,将Co2+氧化成Co3+,
然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化。
实验室用右图装置模拟上述过程:
① 写出阳极电极反应式 。
② 写出除去甲醇的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA代表阿伏加德罗常数,下列说法正确的是( )
A.常温常压下,2克氢气所含原子数目为NA
B.4.6克钠与水反应时失去的电子数目为0.2NA
C.在标准状况下,22.4LNH3所含的质子数目为NA
D.1 L0.5mol•L-1Na2SO4溶液中所含有的Na+离子数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数,下列说法不正确的是( )
A.常温下,22.4 L CO完全燃烧后生成CO2的分子数为NA
B.18 g水中含有的电子数为10NA
C.在1 L 2 mol·L-1的硝酸钙溶液中含有的NO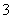 离子数为4NA
离子数为4NA
D.标准状况下,27 g金属铝与足量的稀硫酸反应,生成H2的体积约为33.6 L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com