
常温下,用0.1000 mol·L-1 NaOH溶液分别滴定20.00 mL 0.1000 mol·L-1 盐酸和20.00 mL 0.1000 mol·L-1醋酸溶液,得到两条滴定曲线,如下图所示,若以HA表示酸,下列说法正确的是:( )

A.滴定盐酸的曲线是图2
B.达到B、E状态时,反应消耗的n(CH3COOH)>n(HCl)
C.达到B、D状态时,两溶液中离子浓度均为c(Na+)=c(A-)
D.当0 mL<V(NaOH)<20.00 mL时,对应混合液中各离子浓度大小顺序为
c(A-)>c(Na+)>c(H+)>c(OH-)
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
下列储存药品的方法中,正确的是
A.浓硫酸保存在橡胶塞试剂瓶中
B.浓硝酸保存在无色试剂瓶中
C.金属钠保存在煤油中
D.氢氧化钠溶液保存在玻璃塞试剂瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
胆矾(CuSO4·5H2O)是铜的重要化合物,有着广泛的应用。以下是CuSO4·5H2O的实验室制备流程图。

完成下列各题:
Ⅰ.(1)向含铜粉的稀硫酸中滴加浓硝酸,随着铜粉的溶解可能观察到的实验现象 ▲ 、 ▲ 。
(2)制得的胆矾晶体(CuSO4·5H2O)中可能存在的杂质是 ▲ (写化学式)。
(3)采用重量法测定CuSO4·5H2O的含量时,步骤如下:
①取样,称量 ②加水溶解 ③加氯化钡溶液生成沉淀 ④过滤(其余步骤省略)
在过滤前,需要检验是否沉淀完全,其操作是 ▲ 。
Ⅱ. 某研究性学习小组用ZRY-1型热重分析仪对12.5克硫酸铜晶体(CuSO4·5H2O)进行热重分析,随温度的升高,硫酸铜晶体依次发生下列反应。
a.CuSO4·5H2O CuSO4+5H2O
CuSO4+5H2O
b.CuSO4 CuO+SO3↑,2SO3
CuO+SO3↑,2SO3 2SO2+O2
2SO2+O2
c.4CuO 2Cu 2 O+O2↑
2Cu 2 O+O2↑
请回答下列问题:
(1)实验过程中热重分析仪测得残留固体质量为3.8 g,试推断该固体的组分是 ▲ (写化学式),其对应的物质的量之比是 ▲ 。
(2)热重分析仪加热晶体至恒重后,将全部气体导出,通入氢氧化钡溶液充分反应,所得沉淀经过滤、洗涤、干燥,质量为 ▲ g。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)乙醇在铜或银作催化剂的条件下,可以被空气中的氧气氧化成X,X可发生银镜反应,请写出X被银氨溶液氧化的反应方程式(标出具体反应条件):________ ______________________________。
______________________________。
(2)乙醇可以与酸性重铬酸钾溶液反应,被直接氧化成Y,Y含有官能团的名称是________。在浓硫酸存在下加热,乙醇与Y反应可生成一种有香味的物质W,化学方程式为________________________________________。
(3)现有两瓶无色液体,分别盛有Y、W,只用一种试剂就可以鉴别,该试剂可以是____________________________________。
(4)现代石油化工采用银作催化剂,乙烯能被氧气氧化生成环氧乙烷( )该反应的原子利用率为100%,反应的化学方程式为___________。
)该反应的原子利用率为100%,反应的化学方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:
从A出发,发生图示中的一系列反应,其中B和C按1:2反应生成Z,F和E按1:2反应生成W,W和Z互为同分异构体。

回答下列问题:
(1)写出反应类型:① ,② 。
(2)写出化学反应方程式:
③
④
(3)与B互为同分异构体,属于酚类且苯环上只有两个互为对位取代基的化合物有4种,其结构简式为  , ,
, ,
(4)A的结构简式可能为(只写一种即可) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素A、B、C、D、E原子序数依次增大。A是周期表中原子半径最小的元素,B是形成化合物种类最多的元素,C是自然界含量最多的元素,D是同周期中金属性最强的元素,E的负一价离子与C的某种氢化物W分子含有相同的电子数。
(1)A、C、D形成的化合物中含有的化学键类型为 ;W的电子式 。
(2)已知:①2E· → E-E;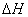 =-a kJ·mol-1 ② 2A· → A-A;
=-a kJ·mol-1 ② 2A· → A-A;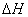 =-b kJ·mol-1 ③E·+A· → A-E;
=-b kJ·mol-1 ③E·+A· → A-E;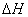 =-c kJ·mol-1
=-c kJ·mol-1
写出298K时,A2与E2反应的热化学方程式 。
(3)在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2A2(g)+BC(g) X(g);
X(g);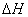 =-a KJ·mol-1(a>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
=-a KJ·mol-1(a>0,X为A、B、C三种元素组成的一种化合物)。初始投料与各容器达到平衡时的有关数据如下:
| 实验 | 甲 | 乙 | 丙 |
| 初始投料 | 2 mol A2、1 mol BC | 1 mol X | 4 mol A2、2 mol BC |
| 平衡时n(X) | 0.5mol | n2 | n3 |
| 反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
| 体系的压强 | P1 | P2 | P3 |
| 反应物的转化率 |
|
|
|
①在该温度下,假设甲容器从反应开始到平衡所需时间为4 min,则A2的平均反应速率 ( A2)为 。
( A2)为 。
②该温度下此反应的平衡常数K的值为 。
③下列现象能说明甲容器中的反应已经达到平衡状态的有 (填序号)。
A. 容器内A2、BC、X的物质的量之比为2:1:1
B. 容器内气体的密度保持恒定
C. 容器内A2气体的体积分数保持恒定
D.2V正(A2)=V逆(BC)
④三个容器中的反应分别达平衡时各组数据关系正确的是 (填序号)。
A.α1+α2=1 B.Q1+Q2=a C.α3<α1
D.P3<2P1=2P2 E.n2<n3<1.0mol F.Q3=2Q1
(4)在其他条件不变的情况下,将甲容器的体系体积压缩到1L,若在第8min达到新的平衡时A2的总转化率为75%,请在上图中画出第5min 到新平衡时X的物质的量浓度的变化曲线。
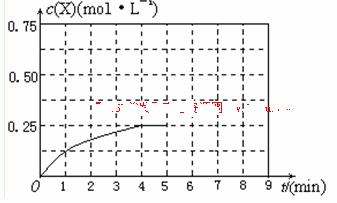
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验的现象与对应结论均正确的是
| 选项 | 操作 | 现象 | 结论 |
| A | 常温下将铁片分别放在浓硝酸和稀硝酸中 | 在浓硝酸中无明显变化,稀硝酸中有气泡 | 稀硝酸的氧化性比浓硝酸强 |
| B | 将一小块Na放入无水乙醇中 | 产生气泡 | Na能置换出醇羟基中的氢 |
| C | 将水蒸气通过灼热的铁粉 | 铁粉变成红棕色粉末 | 铁与水在高温下发生反应 |
| D | 常温下将Al片放入浓硫酸中 | 无明显变化 | Al与浓硫酸不反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关实验的做法正确的是( )
A.分液时,分液漏斗中的上层液体应由下口倒出
B.用加热分解的方法不能区分碳酸钠和碳酸氢钠两种固体
C.配制0.100 0 mol·L-1氯化钠溶液时,将液体转移到容量瓶中需用玻璃棒引流
D.检验NH4+时,往试样中加入NaOH溶液,微热,用湿润的蓝色石蕊试纸检验逸出的气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com