
| A、用食盐腌制食物 |
| B、用漂粉精消毒游泳池中的水 |
| C、用汽油洗涤衣物上的油污 |
| D、用盐酸除去铁钉表面的铁锈 |


科目:高中化学 来源:2014-2015学年山东省高三上学期12月月考化学试卷(解析版) 题型:实验题
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定,在酸性环境中会生成单质S。
Ⅰ制备Na2S2O3·5H2O反应原理:Na2SO3(aq)+S(s) 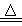 Na2S2O3(aq)
Na2S2O3(aq)
实验步骤:
①称取15 g Na2SO3加入圆底烧瓶中,再加入80 mL蒸馏水。另取5 g研细的硫粉,用3 mL乙醇润湿,加入上述溶液中。
②安装实验装置(如图所示,部分夹持装置略去),水浴加热,微沸60 min。
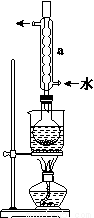
③趁热过滤,将滤液水浴加热浓缩,冷却析出Na2S2O3·5H2O,经过滤、洗涤、干燥,得到产品。
回答问题:
(1)仪器a的名称是________,其作用是____________________。
(2)产品中除了有未反应的Na2SO3外,最可能存在的无机杂质是______________。检验是否存在该杂质的方法是_________________ 。
Ⅱ测定产品纯度
准确称取W g产品,用适量蒸馏水溶解,以淀粉作指示剂,用0.100 0 mol·L-1碘的标准溶液滴定。反应原理为2S2O32-+I2===S4O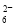 +2I-
+2I-
(3)滴定至终点时,溶液颜色的变化:________________________________。
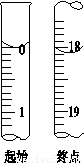
(4)滴定起始和终点的液面位置如图,则消耗碘的标准溶液体积为______mL。产品的纯度为(设Na2S2O3·5H2O相对分子质量为M)______________。
(5)如果滴定终点时俯视刻度线,所的结果 (填“偏大”“偏小”或“不变”)
Ⅲ.Na2S2O3的应用
(6)Na2S2O3还原性较强,在溶液中易被Cl2氧化成SO42-,常用作脱氯剂,该反应的离子方程式为______________________________________ ______。
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
 假蜜环菌甲素可作为药物用于治疗急性胆道感染病毒性肝炎等疾病,其结构简式如下.下列对假蜜环菌甲素的性质叙述正确的是( )
假蜜环菌甲素可作为药物用于治疗急性胆道感染病毒性肝炎等疾病,其结构简式如下.下列对假蜜环菌甲素的性质叙述正确的是( )| A、假蜜环菌甲素可以发生消去反应 |
| B、1 mol假蜜环菌甲素可与 6 molH2发生加成反应 |
| C、假蜜环菌甲素可与 NaOH 溶液在加热条件下发生水解反应 |
| D、假蜜环菌甲素既能与Na反应生成H2,又能与NaHCO3反应生成CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、25℃时,pH=4.7浓度均为0.1mol?L-1的CH2COOH、CH3COONa混合溶液中,c(CH3COO-)+c(OH-)<c(CH3COOH)+c(H+) |
| B、常温下,氨水与(NH4)2SO4溶液混合所得pH=7的溶液中,c(NH4+):c(SO42-)=2:1 |
| C、将体积相同,pH均为1的盐酸和醋酸分别加水稀释至pH=3,盐酸的体积变化大,证明醋酸是弱酸 |
| D、向2.0ml浓度均为0.1mol?L-1的KCl、KI混合液中滴加1-2滴0.01mol?L-1AgNO3溶液,振荡,沉淀呈黄色,说明AgCl的Ksp比AgI的Ksp小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分子晶体中,分子间作用力越大分子越稳定 |
| B、分子晶体都是由共价分子构成的 |
| C、离子晶体中可能含有共价键 |
| D、原子晶体中只存在非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
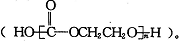 下列有关说法不正确的是( )
下列有关说法不正确的是( )| A、乙二醇可作汽车抗冻液 |
| B、减少CO2的排放可防止酸雨 |
| C、该塑料是一种有机高分子材料 |
| D、链节上酯基的水解有利于降解发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 弱电解质 | H2CO3 | NH3?H2O |
| 电离平衡常数(25℃) | Ka1=4.3×10-7 Ka2=5.61×10-1 | Kb=1.77×10 |
| Kw |
| Kb |
| Kw |
| Ka2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com