
| 起始温度t1/℃ | 终止温度t2/℃ | 温度差 (t2-t1)/℃ | |||
| HCl | NaOH | 平均值 | |||
| 1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
| 2 | 24.5 | 24.2 | 24.45 | 27.6 | 3.15 |
| 3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
分析 (1)量取50mL盐酸或者NaOH 溶液使用仪器为量筒和胶头滴管;
(2)中和热的测定中,完全反应后混合溶液的最高温度为终止温度;
(3)先判断数据的有效性,然后计算出平均温度差,再根据Q=m•c•△T计算反应放出的热量;
(4)a.实验装置保温、隔热效果差,热量散失较大;
b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大;
c.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中,热量散失较大;
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度,硫酸的起始温度偏高;
(5)根据中和热的概念和实质来回答.
解答 解:(1)在该实验中,量取50mL盐酸或NaOH溶液,需要用到的是50mL量筒和胶头滴管;
故答案为:50mL量筒和胶头滴管;
(2)氢氧化钠溶液与盐酸完全反应后混合溶液的最高温度为终止温度;
故答案为:完全反应后混合溶液的最高;
(3)第三次得到温度差误差较大,应该舍弃,所以温度差平均为3.2℃,溶液的质量为100ml×1g/ml=100g,所以反应中放出的热量是4.2J/(g•℃)×100g×3.25℃=1344J;
故答案为:1344;
(4)a.实验装置保温、隔热效果差,热量散失较大,所得中和热的数值偏小,故a正确;
b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,放出的热量偏高,则大于57.3kJ•mol-1,故b错误;
c.分多次把NaOH溶液倒入盛有稀硫酸的小烧杯中,热量散失较大,所得中和热的数值偏小,故c正确;
d.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,硫酸的起始温度偏高,测得的热量偏小,中和热的数值偏小,故d正确;
故答案为:acd;
(5)由于中和热的均是强酸和强碱反应生成1mol水时放出的热,与酸碱的用量无关,所以用60mL0.5mol•L-1盐酸跟50mL0.55mol•L-1氢氧化钠进行反应,实验操作均正确,与上述实验相比,所求的中和热相等;
故答案为:相等.
点评 本题考查了中和热的测定方法,题目难度中等,明确测定中和热的原理是解题的关键,注意掌握中和热的概念及计算方法.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑥ | B. | ②③⑥ | C. | ①④⑤ | D. | ②③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 海水晒盐属于化学变化 | B. | 电动车充电是化学能转变为电能 | ||
| C. | 不锈钢属于复合材料 | D. | 燃油以雾状喷出有利于完全燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3(s)═CaO(s)+CO2(g)在室温下不能自发进行,说明该反应的△H<0 | |
| B. | 焓变和熵变是判断反应方向的两个主要因素 | |
| C. | N2(g)+3H2(g)?2NH3(g)△H<0,其他条件不变时升高温度,反应速率v(H2)和H2的平衡转化率均增大 | |
| D. | 任何情况下,温度都不可能对反应的方向起决定性作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钡可以从氯化钾溶液中置换出钾 | |
| B. | 钡可以从冷水中置换出氢而得到氢气 | |
| C. | 钡可以从氯化钠溶液中置换出钠 | |
| D. | 钡不能置换出金属钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 16.9g过氧化钡(BaO2)固体中阴、阳离子总数约为0.2NA | |
| B. | 常温常压下,28 g乙烯和环丁烷(C4H8)的混合气体中含有的碳原子数为2NA | |
| C. | 标准状况下,0.1mol Cl2溶于水,转移的电子数目小于0.1 NA | |
| D. | 某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
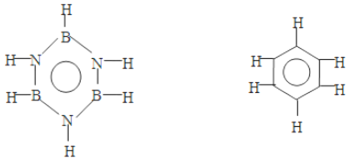
| A. | 2,3 | B. | 1,4 | C. | 2,4 | D. | 4,6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com